
分析 能与碳酸钠溶液反应说明含有羧基,能与银氨溶液反应,说明含有醛基,E既能与碳酸钠溶液反应,又能与银氨溶液反应,说明E为HCOOH,B氧化后生成E,B用氢气还原生成D,则B为HCHO,D为CH3OH,A的水解产物之一也是D,另一产物与硝酸、硝酸银混合液反应,生成黄色沉淀,黄色沉淀为AgI,则A为CH3I,C水解生成CH3OH和HCOOH,说明C为HCOOCH3,据此分析.
解答 解:(1)E既能与碳酸钠溶液反应,又能与银氨溶液反应,说明E为HCOOH,B氧化后生成E,B用氢气还原生成D,则B为HCHO,D为CH3OH,A的水解产物之一也是D,另一产物与硝酸、硝酸银混合液反应,生成黄色沉淀,黄色沉淀为AgI,则A为CH3I,C水解生成CH3OH和HCOOH,说明C为HCOOCH3,
故答案为:CH3I;HCHO;HCOOCH3;
(2)B用氢气还原生成D,则B为HCHO,D为CH3OH,化学方程式为:HCHO+H2$\stackrel{催化剂}{→}$CH3OH,A为CH3I,其水解方程式为:CH3I+NaOH$→_{△}^{水}$CH3OH+NaI,C水解生成CH3OH和HCOOH,说明C为HCOOCH3,其水解方程式为:HCOOCH3+H2O$→_{△}^{水}$HCOOH+CH3OH,
故答案为:HCHO+H2$\stackrel{催化剂}{→}$CH3OH;CH3I+NaOH$→_{△}^{水}$CH3OH+NaI;HCOOCH3+H2O$→_{△}^{水}$HCOOH+CH3OH.
点评 本题考查了有机推断的相关知识,注意各官能团的性质是解题的关键,甲酸既能与碳酸钠溶液反应,又能与银氨溶液反应是解题的突破口,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 33.3mL | C. | 100mL | D. | 66.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入HCl | ||
| C. | 加入适量的NaOH(固体) | D. | 加入固体NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
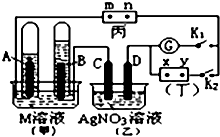 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
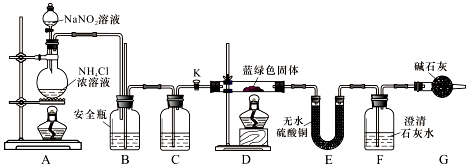
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com