
【题目】实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
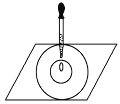
A. 此实验表明氯水具有酸性、漂白性
B. 内环呈白色外环呈红色或浅红色
C. 氯水中形成次氯酸的反应中还原产物是 HClO
D. 内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
【答案】C
【解析】
氯水中有分子:H2O、 Cl2、HClO; 离子:H+、Cl-、ClO-、OH-;H+有酸性,能使蓝色石蕊试纸变红;HClO有漂白性,能使变红的试纸褪色。所以将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现半径慢慢扩大的内外两个圆环,且两环颜色不同。
A、由氯水的成分可知,该实验能表明氯水具有酸性、漂白性,故A正确; B、内环呈白色外环呈红色或浅红色,内环是HClO起作用,外环是H+起作用,故B正确; C、Cl2+H2O=HCl+HClO,还原产物是HCl、HClO是氧化产物,故C错误;D、内环呈白色外环呈红色或浅红色,内环是HClO起作用,外环是H+起作用,内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快,故D正确。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )

A.2mol Br2、3mol NaOH B.3mol Br2、3mol NaOH
C.3mol Br2、4mol NaOHD.4mol Br2、4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______。
(3)容量瓶使用前检验漏水的方法是_______。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________;
②摇匀后发现液面低于刻度线再加水,_____________;
③容量瓶中原有少量蒸馏水,_______________;
④定容时观察液面俯视,_____________;
⑤未将洗涤液注入容量瓶中,_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是
A. 表示酶催化反应的反应速率随反应温度的变化
表示酶催化反应的反应速率随反应温度的变化
B. 表示向Ba(OH)2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
表示向Ba(OH)2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C. 表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D. 表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g) ![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1<p2 m+n>p放热反应
B.T1>T2 p1<p2 m+n<p吸热反应
C.T1<T2 p1>p2 m+n>p放热反应
D.T1>T2 p1<p2 m+n>p吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
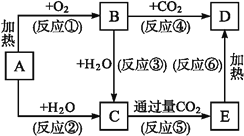
请填写下列空白:
(1)写出化学式:A ,B ,D 。
(2)以上反应中,属于氧化还原反应的有 (填编号)。
(3)写出E![]() D的化学方程式: 。
D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A,B,C在周期表中所处的位置如图所示。A,B,C三种元素原子的质子数之和为37,D元素原子的最外层电子数为次外层电子数的3倍。则下列说法正确的是
B | ||
A | C |
A.元素C形成的一种氧化物具有漂白性能使品红溶液和石蕊试液褪色
B.B,C两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在高温下,元素A的氧化物可与它同主族的单质反应制取A的单质并生成![]()
D.四种元素形成的气态氢化物中,D元素形成的氢化物的稳定性最强,沸点也最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或结论不正确的是( )

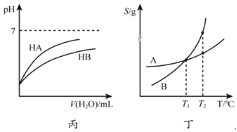
A.由甲可知:使用催化剂降低了反应的活化能
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)N2O4(g),A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com