
【题目】强酸性溶液X中可能含有Na+、K+、NH![]() 、Fe2+、Al3+、CO
、Fe2+、Al3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:
、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:
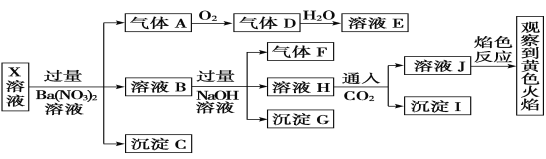
下列结论正确的是( )
A.X中肯定存在Na+、Fe2+、Al3+、NH![]() 、SO
、SO![]()
B.X中不能确定的离子是Al3+、Na+、K+和Cl-
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3
D.气体F经催化氧化可直接生成气体D
【答案】B
【解析】
①强酸性溶液中CO32-、SO32-、NO2-不能大量共存;
②X溶液中加入过量Ba(NO3)2溶液生成沉淀C,则沉淀C是BaSO4,说明有SO42-存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O),NO与O2反应生成NO2,则气体D为NO2,溶液E为稀硝酸溶液;
③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH4+存在;
④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有Al(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在Cl-;以此解答。
A.由上述分析可知,X中肯定存在SO42-、Fe2+、NH4+,故A错误;
B.由上述分析可知,X中不能确定的离子是:Al3+、Na+、K+和Cl-,故B正确;
C.由上述分析可知,沉淀C一定是BaSO4,沉淀G一定是Fe(OH)3,而沉淀I中不一定有有Al(OH)3,故C错误;
D.NH3与O2发生催化氧化生成物为NO、H2O,不能直接生成NO2,故D错误;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子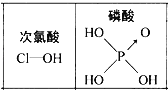
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.1mol Na2O2晶体中含离子数为4NA
C.22.4LCH4的分子数为NA
D.26g C2H2中π键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
选项 | 实验目的 | 甲中物质 | 乙中物质 | 丙中物质 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 比较H2CO3和H2SiO3的酸性 | 稀硫酸溶液 | 碳酸钠 | 硅酸钠溶液 | |
D | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色 石蕊试纸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子数为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
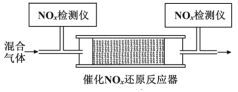
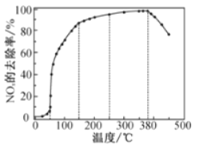
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
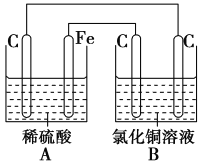
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学理论较为枯燥,若用化学实验来阐释理论,则会使理论具有趣味性,某班级化学学习小组通过实验室制备CO2的反应探究某些化学理论。下表是实验过程中的数据及相关信息:
序号 | 反应 温度/℃ | c(HCl)/(mol·L-1) | V(HCl)/mL | 10g CaCO3 的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t1 |
② | 20 | 4 | 10 | 块状 | t2 |
③ | 20 | 2 | 10 | 粉状 | t3 |
④ | 40 | 2 | 10 | 粉状 | t4 |
⑤ | 40 | 4 | 10 | 粉状 | t5 |
![]() 表示收集/span>CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
表示收集/span>CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
(1)由表中的信息可知,实验的目的是探究__________。
(2)表格中的实验①和实验②是探究_____对化学反应速率的影响。分析表格中的信息可知,影响该化学反应速率的因素还有______________________________。
(3)收集a mLCO2所需的时间最少的是实验______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
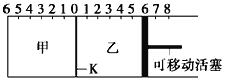
A.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
B.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
C.达到平衡后,隔板K最终停留在左侧刻度0~1之间
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6刻度的右侧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com