
【题目】如图所示三套实验装置,分别回答下列问题。
图1
图2
图3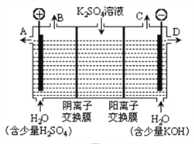
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为___________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
【答案】原电池2H2O+O2+4e-=4OH-2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑b a→bC2H5OH-12e-+3H2O=12H++2CO22H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑A2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸
2OH-+H2↑+Cl2↑b a→bC2H5OH-12e-+3H2O=12H++2CO22H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑A2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸
【解析】
(1)①K与a连接形成原电池反应,发生吸氧腐蚀,B电极铁做负极失电子生成亚铁离子,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子;
②K与b连接形成电解池,与电源正极相连的A电极为阳极,溶液中氯离子失电子生成氯气,与电源负极相连的B电极为电解池的阴极,溶液中氢离子得到电子生成氢气,电解氯化钠溶液生成氢氧化钠、氢气和氯气;
(2)在燃料电池中,燃料在负极发生失电子的反应,电流在电路中从正极流向负极;
(3)电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应,电解产生的氢氧化钾在阴极产生.
(1)①K与a连接形成原电池反应,发生吸氧腐蚀,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-;
②K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,即B电极反应为2H++2e-=H2↑;电解饱和食盐水生成氢氧化钠、氢气和氯气,电解总反应的离子方程式为 2H2O+2Cl-![]() 2OH-+H2↑;
2OH-+H2↑;
(2)①燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,电流在电路中从正极流向负极,根据质子移动方向,可以知道b是正极,a是负极;
②该电池负极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+;
(3)①电解时,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑;
②阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑,阳极氢氧根离子放电,因此硫酸根离子向阳极移动,该电极上会产生硫酸,阴极氢离子放电,因此钾离子向阴极移动,电解产生的氢氧化钾在阴极生成,所以氢氧化钾溶液从出口D流出,制得的硫酸溶液从A口流出。即:制得的硫酸溶液从出口A流出,由于阳极2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大,SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】右图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )

A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学分别按图1所示装置进行实验,甲同学在虚线框内接一个电流计,乙同学在虚线框内没有做连接,请回答下列问题:
(1)以下叙述正确的是______
A.甲同学实验中,石墨棒上无气泡产生
B.甲、乙两同学实验中的铁片都是负极
C.甲同学实验中,电子在溶液中没有迁移
D.甲、乙同学在实验中都发现有气泡生成,产生气泡的速率甲比乙慢
(2)甲同学观察到电流计指针发生偏转,根据实验中的发现,绘制了图2,X轴表示实验时流入正极的电子的物质的量,则Y轴可能表示______
A.石墨棒的质量B.铁棒的质量C.c(H+)D.c(SO42-)E.c(Fe2+)
(3)采用甲同学装置,实验时把稀硫酸换成硫酸铜溶液,请写出铁电极电极反应式:______,石墨电极观察到的现象______,发生了______反应(填“氧化”、“还原”或“非氧化还原”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
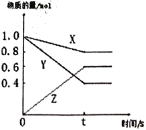
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A.氨遇硫酸冒白烟
B.氨在一定条件下能与氧气反应生成一氧化氮和水
C.氨是一种极易溶于水,且易液化的气体
D.氨能使酚酞试液变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com