
【题目】下列物质互为同分异构体的是( )
A.1H和2HB.O2和O3
C.CH4和C2H6D.CH3CH2OH和CH3OCH3
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
① X、Y、Z的物质的量之比为1:2:2 ② X、Y、Z的浓度不再发生变化
③ X、Y、Z的浓度相等时 ④ 单位时间内消耗nmolX,同时生成2nmolZ
⑤ 2υ正(X)=υ逆(Y) ⑥ 容器中的压强不再发生变化
⑦ 密闭容器内气体的密度不再变化 ⑧ 密闭容器内气体的平均相对分子质量不再变化
A. ③⑤⑥⑦ B. ①③④⑦
C. ②④⑧ D. ②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(Ⅱ).某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
(5)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
图1
图2
图3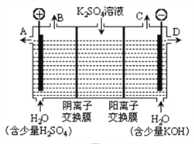
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为___________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化的表达合理的是( )
A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
B.标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
C.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

请回答:
(1)仪器a的名称是_____________。
(2)装置B中冰水的作用是_________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是______。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下图装置的说法中正确的是( )

A. 溶液中pH明显下降
B. 铁片为正极,镀锌铁片为负极
C. 铁片的电极反应式:Fe-2e-=Fe2+
D. 电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常电动汽车使用的是锂电池,制备锂电池正极材料的主要原料为四氧化三钴,工业上用CoCl2·6H2O制备四氧化三钴。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
(1)“酸浸”
①写出滤渣A主要成分的一种用途________。钴的浸出率随酸浸时间、温度的变化关系如图所示。综合考虑,应选择的最佳工艺条件为________。

②Co2O3与浓硫酸反应除生成CoSO4和H2O外,还生成的一种物质是________。
(2)“净化除杂”过程包括除铁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________。
②除铜:加入适量Na2S2O3,发生反应2Cu2++2S2O32-+2H2O=Cu2S↓+S↓+4H++2SO42-,其中氧化产物为___________。
(3)“萃取和反萃取”
①试剂X的名称为_____________。
②实验室称取100 g原料(含钴11.80%),反萃取时得到浓度为0.036 mol·L-1的CoCl2溶液5 L,忽略损耗,钴的产率=_____________。
(4)以CoCl2·6H2O与NH4HCO3为原料,经两步经典反应合成四氧化三钴,第一步在80℃条件下二者生成Co2(OH)2CO3;第二步在600~820℃下Co2(OH)2CO3在空气中转化生成四氧化三钴,写出第二步反应的化学方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com