
【题目】如图所示,通电5min后,C中Cu电极的质量增加1.08g。假设电解过程中溶液的体积不变。
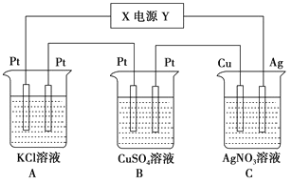
(1)电源中Y是______极。A池中阳极的电极反应式为______,C池中阴极的电极反应式为______。
(2)通电5min后,如果B槽中共收集到112mL气体(标准状况),且溶液体积1000mL,计算通电前溶液中Cu2+的物质的量浓度______。
(3)如果A池溶液是1000mL食盐水(假设电解液足量),则通电5min后,常温下溶液的pH为______。
【答案】正 2Cl--2e-=Cl2↑ Ag++e-=Ag 0.0025mol/L 12
【解析】
C中Cu电极质量增加,说明Cu电极发生反应:Ag++e-=Ag,即Cu电极阴极,则C中Ag电极为阴极,Y为电源正极,X为电源负极。
(1)根据分析可知Y为正极;A中为电解KCl溶液,阳极反应为2Cl--2e-=Cl2↑;C池中阴极反应为Ag++e-=Ag;
(2)生成n(Ag)=0.01mol,则整个电路中转移的电子为0.01mol,B池中阳极反应为4OH--4e-=O2↑+2H2O,转移0.01mol电子时可以生成标况下O2共![]() =0.056L=56mL,而收集到的气体为112mL,说明阴极发了反应2H++2e-=H2↑,产生的氢气的物质的量为
=0.056L=56mL,而收集到的气体为112mL,说明阴极发了反应2H++2e-=H2↑,产生的氢气的物质的量为![]() =0.0025mol,产生氢气转移的电子为0.0025mol×2=0.005mol,则发生Cu2++2e-=Cu反应时转移电子0.01mol-0.005mol=0.005mol,所以n(Cu2+)=0.0025mol,溶液体积为1000mL即1L,所以c(Cu2+)=0.0025mol/L;
=0.0025mol,产生氢气转移的电子为0.0025mol×2=0.005mol,则发生Cu2++2e-=Cu反应时转移电子0.01mol-0.005mol=0.005mol,所以n(Cu2+)=0.0025mol,溶液体积为1000mL即1L,所以c(Cu2+)=0.0025mol/L;
(3)A池中阳极发生:2Cl--2e-=Cl2↑;阴极发生2H++2e-=H2↑,也可以写成2H2O+2e-=H2↑+2OH-,通电5min后转移电子0.01mol,根据电极方程式可知生成n(OH-)=0.01mol,溶液体积为1000mL即1L,所以c(OH-)=0.01mol/L,常温下pH=12。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究![]() 氧化
氧化![]() 制
制![]() 对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ ![]()
![]()
Ⅱ ![]()
![]()
Ⅲ ![]()
![]()
Ⅳ ![]()
![]()
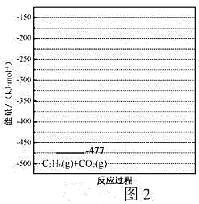
已知:![]() 时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的![]() (
(![]() 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: ![]()
![]() 。
。
请回答:
(1)①根据相关物质的相对能量计算![]() _____
_____![]() 。
。
②下列描述正确的是_____
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:![]()
![]()
![]() ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为![]() )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从![]() 的能量
的能量![]() ,开始(如图2)_____
,开始(如图2)_____
。
(2)①![]() 和
和![]() 按物质的量1:1投料,在
按物质的量1:1投料,在![]() 和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“![]() 氧化
氧化![]() 制
制![]() ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
催化剂 | 转化率 | 转化率 | 产率 |
催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,![]() 氧化
氧化![]() 的主要产物是______,判断依据是_______。
的主要产物是______,判断依据是_______。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高![]() 的选择性(生成
的选择性(生成![]() 的物质的量与消耗
的物质的量与消耗![]() 的物质的量之比)。在
的物质的量之比)。在![]() ,乙烷平衡转化率为
,乙烷平衡转化率为![]() ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到![]() 。结合具体反应说明乙烷转化率增大的原因是_____。
。结合具体反应说明乙烷转化率增大的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的是
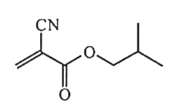
A.其分子式为 C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
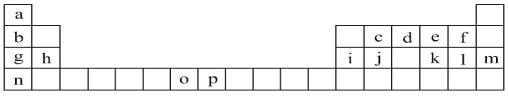
(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为![]() (x=5~3,难溶于熔融硫),下列说法错误的是
(x=5~3,难溶于熔融硫),下列说法错误的是
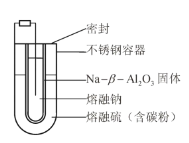
A.Na2S4的电子式为![]()
B.放电时正极反应为![]()
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以![]() 为隔膜的二次电池
为隔膜的二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4·5H2O;然后再分别滴入几滴浓硫酸,观察现象。回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变__(填实验现象),说明浓硫酸具有__性。
(2)浓硫酸滴入CuSO4·5H2O中,胆矾__(填实验现象),说明浓硫酸具有__性。
实验二:按如图所示装置进行实验。玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花。给试管加热,观察现象,一段时间以后,停止加热。
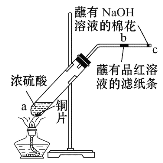
回答下列问题:
(3)写出a处反应的化学方程式:__。
(4)试管中的液体反应一段时间后,b处滤纸条的变化为__。
(5)写出C处NaOH的作__。有关的化学反应方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在足量浓硝酸中加入3.84gCu片,反应完全后,将产生的气体(只含有一种气体)通入800mLH2O中充分反应,设反应前后溶液体积不变。
(1)写出产生的气体通入水中的化学反应方程式,并指出氧化剂与还原剂质量之比___;
(2)试求将气体通入水中充分反应后得到的溶液的物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
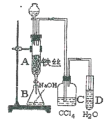
(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
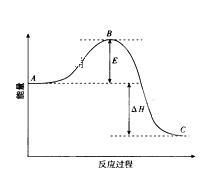
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响_______。
(3)图中A表示SO2(g)和O2(g)的_________。
(4)图中△H的意义是__________。
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式_____,_____;
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com