
【题目】在足量浓硝酸中加入3.84gCu片,反应完全后,将产生的气体(只含有一种气体)通入800mLH2O中充分反应,设反应前后溶液体积不变。
(1)写出产生的气体通入水中的化学反应方程式,并指出氧化剂与还原剂质量之比___;
(2)试求将气体通入水中充分反应后得到的溶液的物质的量浓度___。
【答案】1:2 0.1mol/L
【解析】
(1)根据 NO2与水反应方程式 3NO2+ H2O=2 HNO3+NO 反应方程式中N元素化合价变化判断氧化剂和还原剂物质的量之比;
(2)根据化学反应Cu+4 HNO3=2NO2↑+Cu ( NO3) 2+2H2O和3NO2+ H2O=2 HNO3+NO计算硝酸的浓度。
(1) NO2与水反应方程式 3NO2+ H2O=2 HNO3+NO 反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1: 2,所以起氧化剂和还原剂的NO2的质量比为1:2;
答案:反应方程式 3NO2+ H2O=2 HNO3+NO ,起氧化剂和还原剂的NO2的质量比为1: 2 .
(2) 3.84g Cu的物质的量为n=![]() =0.06mol,令3.84g Cu与足量浓硝酸反应生成的二氧化氮的物质的量为xmol,根据反应方程式Cu+4 HNO3=2NO2↑+Cu ( NO3) 2+2H2O,可知产生NO2为x=0.12mol,通入800mLH2O中发生反应,再根据3NO2+ H2O=2 HNO3+NO 方程式可求生成硝酸的物质的量为n=0.08mol,所以得到的溶液的物质的量浓度c=
=0.06mol,令3.84g Cu与足量浓硝酸反应生成的二氧化氮的物质的量为xmol,根据反应方程式Cu+4 HNO3=2NO2↑+Cu ( NO3) 2+2H2O,可知产生NO2为x=0.12mol,通入800mLH2O中发生反应,再根据3NO2+ H2O=2 HNO3+NO 方程式可求生成硝酸的物质的量为n=0.08mol,所以得到的溶液的物质的量浓度c=![]() =0.1mol/L,
=0.1mol/L,
故答案:0.1mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
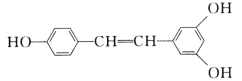
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,
装置如图所示,其中Y为CO2。下列说法合理的是( )
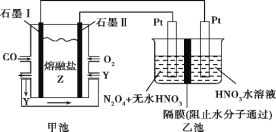
A.石墨Ⅰ是原电池的正极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+
D.若甲池消耗标准状况下的氧气2.24L,则乙池中一定能产生氢气0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,C中Cu电极的质量增加1.08g。假设电解过程中溶液的体积不变。
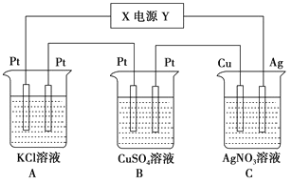
(1)电源中Y是______极。A池中阳极的电极反应式为______,C池中阴极的电极反应式为______。
(2)通电5min后,如果B槽中共收集到112mL气体(标准状况),且溶液体积1000mL,计算通电前溶液中Cu2+的物质的量浓度______。
(3)如果A池溶液是1000mL食盐水(假设电解液足量),则通电5min后,常温下溶液的pH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________,基态Fe原子的电子排布式为__________。
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______。

(3)Fe、Co、Ni能与C12反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______。
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石主要用于制造碳酸锶(SrCO3)以及生产电视机显像管玻璃等,其主要成分是SrSO4,还含有少量BaSO4。测定天青石中钡元素的含量可采用以下方法。
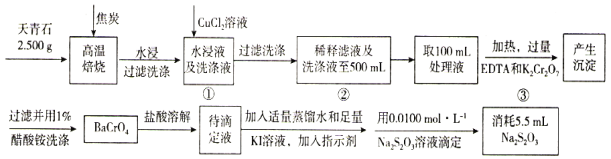
已知:①EDTA可与Sr2+、Cu2+形成配合物;
②BaCrO4在盐酸中溶解,产生Cr2O72-;
③2Na2S2O3+I2=Na2S4O6+2NaI;
④Ksp(CuS)=3.4×10-36。
(1)高温焙烧时SrSO4和BaSO4被过量的焦炭还原为可溶性的SrS和BaS,写出SrSO4与焦炭反应的化学反应方程式________,BaS的电子式为________。
(2)加入EDTA的目的是________________。
(3)过程③的离子反应方程式________________。
(4)若过程①和过程②未将洗涤液与滤液合并会导致测定Ba的含量________(填“偏大”“偏小”或“无影响”)。
(5)滴定时以________为指示剂,滴定终点观察到的现象________。
(6)加入CuCl2,目的是将溶液中的S2-沉淀完全,当溶液中c(Cu2+)为0.1mol/L时,溶液中c(S2-)的浓度为________。
(7)该天青石中钡的质量分数为________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组使用甲烷燃料电池(如图甲所示)作为SO2传感器(如图乙所示)的电源,检测空气中SO2的含量。下列说法错误的是( )
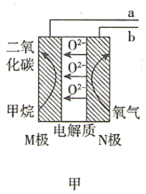
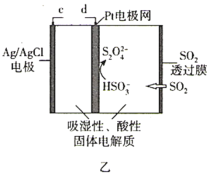
A.甲烷燃料电池M极的电极反应式为CH4-8e-+4O2-=CO2+2H2O
B.甲烷燃料电池的b端连接SO2传感器的c端
C.标准状况下,当甲烷燃料电池的N极消耗2.24L的O2时进入传感器的SO2为4.48L
D.每转移1mol电子,传感器中Ag/AgCl电极质量增加35.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-离子。
甲的实验为:
![]()
(1)乙认为甲的实验不严谨,因为试样A中若含有________离子(仅填一种)也会有此现象。
乙的实验为:
![]()
(2)丙认为乙的实验也不严谨,因为试样B中若含有________离子(仅填一种)也会有此现象。
丙的实验为:
![]()
若丙方案合理,回答:
(3)若丙实验合理,则其中试剂Ⅰ是___________,现象Ⅰ是__________;试剂Ⅱ是___________,现象Ⅱ是__________。(若你认为丙方案不合理,以上四空可以不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 向氯乙烷中加入硝酸银溶液,可以鉴定其中的氯原子
C. 将等体积的苯、汽油和水在试管中充分振荡后静置,现象如图所示:
![]()
D. 可用灼烧的方法鉴别蛋白质和纤维素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com