
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,
装置如图所示,其中Y为CO2。下列说法合理的是( )
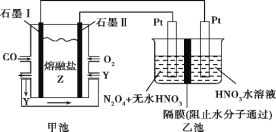
A.石墨Ⅰ是原电池的正极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+
D.若甲池消耗标准状况下的氧气2.24L,则乙池中一定能产生氢气0.02mol
【答案】C
【解析】
据图可知反应过程中CO被氧化为CO2,所以石墨I电极为负极,石墨II为正极,则乙池为电解池,左侧为阳极,右侧为阴极。
A.CO被氧化为CO2,所以石墨I电极为负极,发生氧化反应,故A错误;
B.甲池为原电池,原电池中阴离子流向负极,所以CO32-向石墨I极移动,故B错误;
C.乙池中左端Pt极为阳极,发生氧化反应,N2O4被氧化为N2O5,结合电子守恒和元素守恒可知电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,故C正确;
D.若甲池消耗标准状况下的氧气2.24L即0.1mol,所以整个电路转移电子的物质的量为:0.4mol,所以生成氢气的物质的量为0.2mol,故D错误;
故答案为C。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
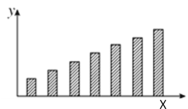
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的是
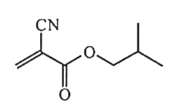
A.其分子式为 C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
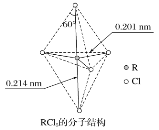
A.并不是每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
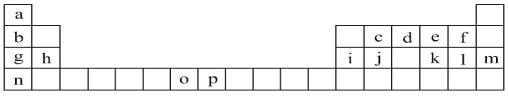
(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为![]() (x=5~3,难溶于熔融硫),下列说法错误的是
(x=5~3,难溶于熔融硫),下列说法错误的是
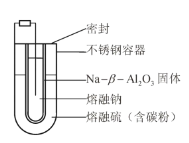
A.Na2S4的电子式为![]()
B.放电时正极反应为![]()
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以![]() 为隔膜的二次电池
为隔膜的二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在足量浓硝酸中加入3.84gCu片,反应完全后,将产生的气体(只含有一种气体)通入800mLH2O中充分反应,设反应前后溶液体积不变。
(1)写出产生的气体通入水中的化学反应方程式,并指出氧化剂与还原剂质量之比___;
(2)试求将气体通入水中充分反应后得到的溶液的物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二酮是一种重要的医药、液晶中间体。以工业原料乙烯为基础的1,4-环已二酮(G)合成线路如图所示:
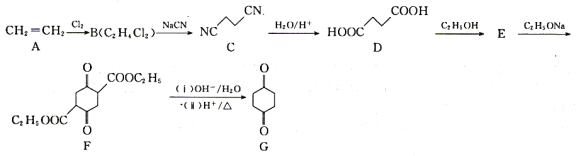
已知:2RCH2COOC2H5![]() +C2H5OH
+C2H5OH
(1)B和E的结构简式分别为________、________。
(2)B→C的反应类型为________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,用星号(*)标出F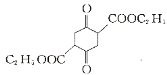 中的手性碳________。
中的手性碳________。
(4)由E→F的化学方程式为________。
(5)同时满足下列条件的G的同分异构体的结构简式________(不考虑立体异构)。
①能发生银镜反应;
②核磁共振氢谱显示为2个峰,且峰面积之比为3:1。
(6)设计由乙烯(CH2=CH2)和乙醇(C2H5OH)制备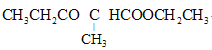 的合成路线________(无机试剂任选)
的合成路线________(无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com