
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是____________________
②反应最剧烈的烧杯是_______(填字母);
③写出b烧杯里发生反应的离子方程式_________________
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A___________B___________
(2)实验步骤: 连接仪器、________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______________,装置E中足量酸性KMnO4溶液的作用是_______________。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________________;
③试管D中发生反应的离子方程式是_________________。
【答案】 验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强) c 2Na+2H2O=2Na++2OH-+H2↑ 分液漏斗 圆底烧瓶 检查装置的气密性 ![]() 除去SO2气体 盛有Na2SiO3溶液的试管中出现白色沉淀 SO2+2HCO3-=SO32-+H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑
除去SO2气体 盛有Na2SiO3溶液的试管中出现白色沉淀 SO2+2HCO3-=SO32-+H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑
【解析】试题分析:锂、钠、钾为ⅠA族金属元素,越活泼的金属越易与水反应,根据与水反应的难易验证金属性的强弱;铜与浓硫酸反应生成二氧化硫,由于亚硫酸的酸性大于碳酸,二氧化硫与碳酸氢钠溶液反应生成二氧化碳。要比较碳和硅两种元素的非金属强弱,通过二氧化碳通入硅酸钠溶液中制取硅酸验证;
解析:根据以上分析(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。可以根据与水反应的难易判断金属性的活泼性;①甲同学设计实验的目的是验证锂、钠、钾的活泼性;
②钾最活泼,反应最剧烈的烧杯是c;
③Na与水发生反应生成氢氧化钠和氢气的离子方程式2Na+2H2O=2Na++2OH-+H2↑;(Ⅱ)通过最高价氧化物对应水合物的酸性强弱来探究碳、硅元素的非金属性强弱,(1)仪器名称A是分液漏斗、B是圆底烧瓶;
(2)涉及到气体的实验,需连接仪器后检验装置气密性。
(3)①铜与浓硫酸反应生成硫酸铜、二氧化硫、水,化学方程式是![]() ;
;
为验证二氧化碳与硅酸钠反应生成硅酸沉淀,装置E中足量酸性KMnO4溶液的作用是除去CO2中SO2气体。
②碳酸的酸性大于硅酸,能说明碳元素的非金属性比硅元素非金属性强的实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀;
③已知酸性,亚硫酸>碳酸,试管D中碳酸氢钠与二氧化硫反应生成二氧化碳,发生反应的离子方程式是SO2+2HCO3-=SO32-+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】已知一定温度压强下,N2(g) + 3H2(g)![]() 2 NH3(g) ΔH = -92 kJ/mol,在同温下向某定容密闭容器甲中通入1.0 mol N2和3.0 mol H2,反应完成时放出热量Q1 kJ,向另一体积相同的定容密闭容器乙中通入1.5 mol N2和3.0 mol H2,相同条件下反应完成时放出热量为Q2 kJ,则下列关系正确的是( )
2 NH3(g) ΔH = -92 kJ/mol,在同温下向某定容密闭容器甲中通入1.0 mol N2和3.0 mol H2,反应完成时放出热量Q1 kJ,向另一体积相同的定容密闭容器乙中通入1.5 mol N2和3.0 mol H2,相同条件下反应完成时放出热量为Q2 kJ,则下列关系正确的是( )
A.2 Q2 = Q1 = 92.4 B.Q2 < Q1 < 92.4 C.Q1 = Q2 = 92.4 D.Q1 < Q2 < 92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境日益引起人们的重视.下列做法有利于保护环境的是( )
A.氢能源代替化石能源
B.推广使用太阳能电池
C.电动汽车代替燃油汽车
D.造纸厂污水直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应进行分类时,既属于氧化还原反应又属于化合反应的是
A.CO2+H2O═H2CO3 B.2KClO3═2KCl+3O2↑ C.S+O2═SO2 D.2O3═3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模转染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[ Ca(OH)2 ]制漂白粉,反应的化学方程式为 。
(2)漂白粉的有效成分是 (填化学式 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为常温下向25 mL 0.1 mol/L MOH溶液中逐滴滴加0.2 mol/L HCl溶液过程中溶液pH的变化曲线。下列推断正确的是
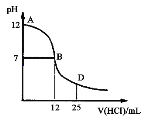
A.MOH在水中的电离方程式是:MOH=N++OH-
B.在B点表示酸碱恰好中和
C.A点→D点,溶液的导电能力逐渐增强(忽略体积变化)
D.在D点时,存在c(H+)>c(OH-)>c(Cl-)>c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
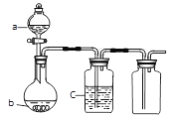
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com