
����Ŀ��п������������Ԫ�أ�������������Ҫ�Ĺ��ܣ�Ȼ�����ȵ�Zn2+�������ԣ�����ܹ���Ч���������Zn2+�ķ����dz���Ҫ��������L��Zn2+�и�ʶ�����������õĿ������ԣ���ϳ�·�߿�������£�
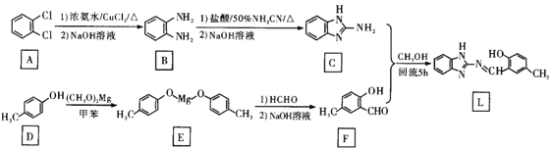
�ش��������⣺
(1)A�Ļ�ѧ����Ϊ____________F�Ĺ���������Ϊ____________��
(2)D����E�Ļ�ѧ����ʽΪ________________���÷�Ӧ����Ϊ____________��
(3)��֪R-N=N-R�����е�Nԭ�Ӵ��ڹ¶Ե���(δ���õ��Ӷ�)����N = N˫��������ת���������˳���칹��![]() (˳ʽ)��
(˳ʽ)��![]() (��ʽ)���жϻ�����L�Ƿ����˳���칹________(����������������)��
(��ʽ)���жϻ�����L�Ƿ����˳���칹________(����������������)��
(4)�о���Ա����ij���������з��������ֻ�����L���ǰ���(-NH-)��-OH�ϵ���ԭ�ӵ�.���շ��ڽ��Zn2+�����ͼ����ʧ����������������___________�ǣ��о���Ա�Ʋ⻯����L���Zn2+�Ļ���Ϊ��![]() ���У�Zn2+��-N=֮�乲�ۼ��ijɼ���ʽ��________(����)��
���У�Zn2+��-N=֮�乲�ۼ��ijɼ���ʽ��________(����)��
a. Zn2+��Nԭ�Ӹ����ṩ��������ɹ��õ��Ӷ�
b. Zn2+�������ṩ���Ӷ���Nԭ�ӹ���
c. Nԭ�ӵ������ṩ���Ӷ���Zn2+����
(5)XΪF�ķ�����ͬ���칹�壬д����������������X�Ľṹ��ʽ_____________��
���ܷ���ˮ�ⷴӦ��������Ӧ������֮һ����FeCl3��Һ������ɫ��Ӧ��
�������ֲ�ͬ��ѧ�������⣬������Ϊ3��1��1��1��1��1��
(6)��֪��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���������Y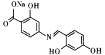 �����־����ԣ���
�����־����ԣ���![]() ��
��![]() Ϊԭ���Ʊ�Y��д���ϳ�·��(�л��ܼ������Լ���ѡ)��____________��
Ϊԭ���Ʊ�Y��д���ϳ�·��(�л��ܼ������Լ���ѡ)��____________��
���𰸡��ڶ��ȱ� ȩ�����ǻ� 2![]() +(CH3O)Mg
+(CH3O)Mg![]()
![]() +2CH3OH ȡ����Ӧ �� �˴Ź����� c
+2CH3OH ȡ����Ӧ �� �˴Ź����� c 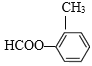 ��
��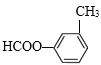
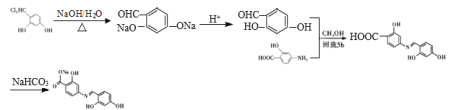
��������
(1)�����л��������������������F�ṹ��ʽ�жϹ����ŵ����ƣ�
(2)��������ͼ�жϷ�Ӧ���ͣ���д��Ӧ����ʽ��
(3)���ж�L���Ƿ����N=N˫����Ȼ����ݺ��е�˫��������ת������˳���칹������
(4)�ⶨHԭ����ͼ�������Ǻ˴Ź����ǣ����Nԭ���й¶Ե��ӣ�Zn2+���пչ���жϽ�Ϸ�ʽ��
(5) XΪF�ķ�����ͬ���칹�壬�����������������ܷ���ˮ�ⷴӦ��������Ӧ������֮һ����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ��γɵ�������ȩ����
�������ֲ�ͬ��ѧ�������⣬������Ϊ3��1��1��1��1��1��
(6) ![]() ��NaOH��ˮ��Һ�з�Ӧ����
��NaOH��ˮ��Һ�з�Ӧ����![]() ��Ȼ���ữ�õ�
��Ȼ���ữ�õ�![]() ��
��![]() ��
��![]() ��CH3OH�����»���5Сʱ�õ�
��CH3OH�����»���5Сʱ�õ�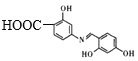 ��������NaHCO3��Һ��Ӧ�õ�Ŀ����
��������NaHCO3��Һ��Ӧ�õ�Ŀ����
(1)A��![]() ������Clԭ���ڱ���������λ�ã�����Ϊ�ڶ��ȱ���������F�ṹ��ʽ��
������Clԭ���ڱ���������λ�ã�����Ϊ�ڶ��ȱ���������F�ṹ��ʽ��![]() ����֪���к��еĹ���������Ϊȩ�����ǻ���
����֪���к��еĹ���������Ϊȩ�����ǻ���
(2)��������ͼ��֪D�ṹ��ʽ![]() ��E��
��E��![]() 2�����ӵ�D��(CH3O)Mg�ڱ���Һ�з���ȡ����Ӧ����F��CH3OH����Ӧ����ʽΪ��2
2�����ӵ�D��(CH3O)Mg�ڱ���Һ�з���ȡ����Ӧ����F��CH3OH����Ӧ����ʽΪ��2![]() +(CH3O)Mg
+(CH3O)Mg![]()
![]() +2CH3OH��
+2CH3OH��
(3)L�ṹ��ʽ��![]() ����L���ӽṹ�к���N=N˫��������N = N˫��������ת���������˳���칹��
����L���ӽṹ�к���N=N˫��������N = N˫��������ת���������˳���칹��
(4)������L���ǰ���(-NH-)��-OH�ϵ���ԭ�ӵ����շ��ڽ��Zn2+�����ͼ����ʧ����ⶨԪ�غ˴Ź�����ͼ�������������Ǻ˴Ź����ǣ�����Zn2+�Ͼ��пչ������-N=��Dԭ�����й¶Ե��ӣ�����Zn2+��-N=֮�乲�ۼ��ijɼ���ʽ��Nԭ�ӵ������ṩ���Ӷ���Zn2+���ã��ʺ���ѡ����c��
(5)������F�ṹ��ʽ��![]() ��XΪF�ķ�����ͬ���칹�壬�����������������ܷ���ˮ�ⷴӦ��������Ӧ������֮һ����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ��γɵ�������ȩ�����������ֲ�ͬ��ѧ�������⣬������Ϊ3��1��1��1��1��1����X���ܵĽṹΪ
��XΪF�ķ�����ͬ���칹�壬�����������������ܷ���ˮ�ⷴӦ��������Ӧ������֮һ����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ��γɵ�������ȩ�����������ֲ�ͬ��ѧ�������⣬������Ϊ3��1��1��1��1��1����X���ܵĽṹΪ ��
�� ��
��
(6) ![]() ��NaOH��ˮ��Һ���ȷ�����Ӧ����
��NaOH��ˮ��Һ���ȷ�����Ӧ����![]() ��
��![]() �м������ữ�õ�
�м������ữ�õ�![]() ��
��![]() ��
��![]() ��CH3OH�����»���5Сʱ�õ�
��CH3OH�����»���5Сʱ�õ� ������
������ ��NaHCO3��Һ��Ӧ�õ�Ŀ�����
��NaHCO3��Һ��Ӧ�õ�Ŀ�����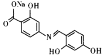 ���ϳ�·��Ϊ
���ϳ�·��Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������ý�����ȷ����
ѡ�� | ʵ����������� | ʵ����� |
A | �ⶨ��Ũ�ȵ�Na2CO3��Na2SO3��Һ��pH��Na2CO3��pH����Na2SO3��Һ | S�ķǽ����Ա�Cǿ |
B | �����£���pH��ֽ��ã�0.1mol��L-1NaHSO3��Һ��pHԼΪ5 |
|
C | ��������ˮ�Ҵ��м���һС������Na�����ɿ�ȼ������ | CH3CH2OH��������� |
D | ��2mL0.1mol��L-1NaOH��Һ�еμ�3��0.1mol��L-1MgCl2��Һ�����ְ�ɫ�������ٵμ�3��0.1mol��L-1FeCl3��Һ�����ֺ��ɫ���� | Ksp[Mg(OH)2]��Ksp[Fe(OH)3] |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ2NO(g)+O2(g)��2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)������Ӧ_____(������������������)���淴Ӧ��
(2)��ͼ��ʾ����ʾNO2�仯���ߵ���____����O2��ʾ0��1s�ڸ÷�Ӧ��ƽ������v=____��

(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����____(����ĸ)��
a��v(NO2)=2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)=2v��(O2) d���������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֵ绯ѧ�Ʊ�NH3��װ����ͼ��ʾ��ͼ���մ��ڸ���ʱ���Դ���H������ش��������⣺
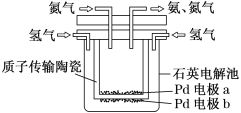
��1����װ�ý�______��ת��Ϊ______�ܡ�
��2��Pd�缫aΪ_____��(ѡ��������������������������������)���缫��ӦʽΪ___��
��3�����Ƶ�6mol����ʱ��____mol ���Ӵ�____��Ǩ�Ƶ�____�� (ѡ����a������b��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1791�꣬����ҽ��·�������Ȼ���Ƽ�ר������ʳ�Ρ�Ũ���ᡢʯ��ʯ��úΪԭ���Ƽ�÷�����������
����NaCl��H2SO4��Ӧ��Na2SO4��2NaCl��H2SO4![]() Na2SO4��2HCl��
Na2SO4��2HCl��
���ý�̿��ԭNa2SO4��Na2S��Na2SO4��4C![]() Na2S��4CO��
Na2S��4CO��
����������ʯ��ʯ��Ӧ��Na2CO3��Na2S��CaCO3![]() Na2CO3��CaS
Na2CO3��CaS
����˵����ȷ���ǣ� ��
A.�ڢ���������������ԭ��Ӧ
B.ֻ�еڢڲ���������ԭ��Ӧ
C.�÷����������豸����û�и�ʴ
D.�÷����Ի�����Ⱦ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�����к��в��ӣ������Dz�Ҷ�ж�������ʵ��ܳƣ���Ŀǰ�в����˹��ϳɵĴ���Ȼ�� ��ܡ���Ч�ܵĿ������������ɻ�������������ûʳ�Ӷ�����(GC)�Ľṹ��ʽ��ͼ��ʾ�����й���GC����������ȷ����( )
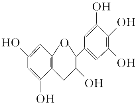
A�����������е�ԭ�ӹ���
B��1 mol GC��6 mol NaOHǡ����ȫ��Ӧ
C���ܷ���������Ӧ��ȡ����Ӧ����ȥ��Ӧ���ѷ����ӳɷ�Ӧ
D����FeCl3��Һ��������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.���Է����еķ�Ӧһ����Ѹ�ٷ���
B.��ӦNH4HCO3(s)��NH3(g)��H2O(g)��CO2(g) ��H����185.57 kJ��mol��1���Է����У�����Ϊ��ϵ���Է�������Ҷ�����ķ���ת�������
C.��Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ر�����Ե�����Ϊ�жϷ�Ӧ�ܷ��Է����е��о�
D.��Ӧ2N2(g)��O2(g)��2N2O(g) ��H����163 kJ��mol��1�ڸ����¿����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ũҩ��Ⱦ�ϡ��ӡ��軯��Լ�����ɫ�ȡ���ζ�ķ�ˮ�����û�ѧ���������д��������õ������������ࣨ��Һ�ȡ�������ơ��������Ƶȣ������ࣨ��������������������⡢������صȣ���һ������ʵ���������������������о綾���軯���CN�����ķ�ˮ���ڼ��������£�pH��8.5��11���������ɽ��軯����CN������Ϊֻ��������![]() �������Σ���CNO������
����������CNO������
��1��д����CN����ˮ�������������������ε����ӷ���ʽ��_________________��
��2������CNO���ķ�ˮ����ͨ����������ʹCNO��ת��Ϊ�������壬д�������Ӧ�����ӷ���ʽ��______________________________________________��
��3������Һ�Ȳ���ĵ���������Ư�۴�����CN���ķ�ˮ������������ΪCNO���������ӷ���ʽΪ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������CO2���⻯�Ƽ��飬�о�����HCOOH��CO2ת��ΪCH4���м��壬����![]() �������Ƿ�ӦI��II�Ĵ�����CH4��HCOOH��H2�IJ��������������Ĺ�ϵ��ͼ��ʾ(���ı�����������������������)��
�������Ƿ�ӦI��II�Ĵ�����CH4��HCOOH��H2�IJ��������������Ĺ�ϵ��ͼ��ʾ(���ı�����������������������)��
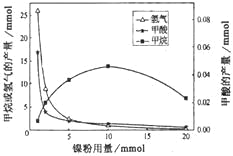
��ͼ��֪��������������1mmol���ӵ�10mmol����Ӧ���ʵı仯�����( )
A.��ӦI���������ӣ���ӦII�����ʲ���
B.��ӦI�����ʲ��䣬��ӦII���������ӡ�
C.��ӦI��II�����ʾ����ӣ��ҷ�ӦI���������ӵÿ�
D.��ӦI��II�����ʾ����ӣ��ҷ�ӦII���������ӵÿ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com