
【题目】用以下三种途径来制取等质量的硝酸铜:①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述不正确的是
A.三种途径所消耗的铜的质量相等
B.所消耗的硝酸的物质的量是①>②>③
C.途径③的制备方法是最符合“绿色化学”理念的
D.途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2
【答案】B
【解析】①铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1mol硝酸铜需要8/3mol硝酸,生成2/3mol有毒的NO气体;②铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2,需要2molHNO3,生成的2molNO2气体有毒,是污染性的气体;③铜与氧气反应生成CuO,2Cu+O2![]() 2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1mol硝酸铜,需要2molHNO3,且没有生成污染性气体;则A.根据铜原子守恒可知制取相同质量的硝酸铜,所消耗的铜的质量相等,A正确;B.制备1mol硝酸铜,①需要8/3mol硝酸;②需要4mol硝酸;③需要2mol硝酸,途径②消耗硝酸最多,途径①次之,途径③消耗硝酸最少,B错误;C.由方程式通过比较可以看出,生成相同质量的硝酸铜,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,所以途径③的制备方法是最符合“绿色化学”理念,C正确;D.途径①中铜与稀硝酸反应,根据方程式可知被氧化的铜与被还原的硝酸的物质的量比是3:2,D正确,答案选B。
2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1mol硝酸铜,需要2molHNO3,且没有生成污染性气体;则A.根据铜原子守恒可知制取相同质量的硝酸铜,所消耗的铜的质量相等,A正确;B.制备1mol硝酸铜,①需要8/3mol硝酸;②需要4mol硝酸;③需要2mol硝酸,途径②消耗硝酸最多,途径①次之,途径③消耗硝酸最少,B错误;C.由方程式通过比较可以看出,生成相同质量的硝酸铜,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,所以途径③的制备方法是最符合“绿色化学”理念,C正确;D.途径①中铜与稀硝酸反应,根据方程式可知被氧化的铜与被还原的硝酸的物质的量比是3:2,D正确,答案选B。


科目:高中化学 来源: 题型:
【题目】在25℃时,对于0.10mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,溶液的pH将_________(填“增大”“减小”或“不变”),这是因为__________。
(2)若向氨水中加入等体积pH=1的硫酸,此时溶液的pH_________7(填“>”“<”或“=”);用离子方程式表示其原因__________________;此时溶液中各离子浓度由大到小的顺序_________________。
(3)向氨水中加入0.05molL-1稀硫酸至溶液正好呈中性,则c(NH4+)________2c(SO42-)(填“>”“<”或“=”),此时混合溶液中c(NH4+)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为__________。
(4)向10ml0.20mol·L-1的氨水中加入10ml 0.02mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀。Ca(OH)2的Ksp=5.5![]() 10-6氨水中c(OH-)≈
10-6氨水中c(OH-)≈![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C. 反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL含NaOH1mol/L的溶液,然后滴加1mol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是

A.原合金质量为0.92g
B.图中V2的值为60
C.图中m的值为1.56
D.产生氢气的体积为896mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中,滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是

A.最终瓶内溶液中的溶质一定只有Cu(NO3)2
B.产生现象②的原因是NO2与水反应
C.产生现象③的原因是铜与稀硝酸反应
D.现象①中产生的红棕色气体为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)Na2O2中O元素的化合价为__________。
(2)如图所示实验,滴入几滴水,现象是,反应的化学方程式为。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是_______________________。
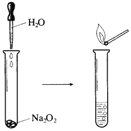
(3)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是___________________Na2O2与H2O、CO2反应,其中与CO2反应的化学方程式为__________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;B ;
(2)写出过量C与D发生反应的离子方程式 。
(3)B溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com