
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,
原因是 。
(2)哪一时间段的反应速率最小 ,原因是
(3)求2~3 min时间段以盐酸的浓度变化来表示的该反应速率 。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
【答案】(1)2~3 min 因该反应是放热反应,2~3 min时温度高
(2)4~5 min 因为4~5 min时H+浓度小
(3)0.1 mol·L-1·min-1
(4)AB
【解析】
试题分析:(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min) 2~3 min生成氢气体积112ml,反应速率最大。原因是因该反应是放热反应,2~3 min时温度高。
(2)4~5 min生成氢气体积20ml,生成氢气最少,反应速率最小,原因是因为4~5 min时H+浓度小
(3)2~3 min生成氢气体积112ml,氢气的物质的量是0.005mol,消耗盐酸0.01mol,![]() =0.1 mol·L-1·min-1。
=0.1 mol·L-1·min-1。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A.蒸馏水使盐酸浓度减小,速率减慢;加入NaCl溶液,使盐酸浓度减小,速率减慢; 加入Na2CO3溶液,碳酸钠消耗氢离子生成二氧化碳和水,所以生成氢气的体积减小;加入CuSO4溶液,锌置换出铜,构成铜锌原电池,反应速率加快。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。己知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是_______________。
(2)C2B2所含的化学键类型有______;请写出C2B2和A2B反应的离子方程式___________。
(3)元素B、C所形成的简单离子中半径较大的是(写电子式)___________。
(4)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_____,如果该电池每转移1mol电子,消耗标准状况下A单质的体积为_______升,通入A单质的X溶液的pH 值将(填“增大”“不变”或“减小”)______;图中盐桥的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
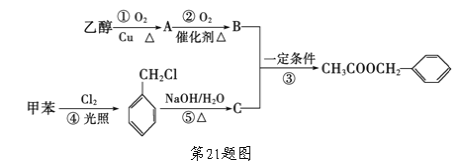
(1)C的结构简式为_______________,B中含氧官能团的名称是____________。
(2)实验室A的方法是:__________________________________________
______________________________________________________________。
(3)写出反应①、⑤的化学方程式:
① ________________________________________;
⑤ ________________________________________。
(4)反应③、④的反应类型分别为③____________、④____________。
(5)反应____(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是生物体的一种代谢产物,菠菜、苋菜等植物中富含草酸,但在人体中容易与钙离子形成草酸钙导致肾结石。某化学研究小组为了研究草酸,查阅资料获取了以下信息。
① 草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易升华,易溶于水。
② 草酸晶体受热脱水,170℃以上分解产生CO、CO2和H2O。
③ 草酸为二元酸:K1=5.4×10-2,K2=5.4×10-5。
④ 草酸的钠盐和钾盐易溶于水。
(1)研究小组为了验证草酸受热分解产生的CO2,按照如下图所示的装置进行实验。装置B中可观察到的现象是 。但研究小组指导老师认为实验方案欠妥,要求改进实验。小组同学一致同意在A、B之间再加入一个实验装置C,其作用是 ,请在下图方框中画出该装置,并标明所需试剂。

(2)研究小组为了验证草酸受热分解产生的CO,按照(1)实验中的装置A、C和下图所示的部分装置(可以重复选用)进行实验。

实验装置依次连接的合理顺序为A→C→ →H→D→I。装置H反应管中盛有的物质是 。
(3)经过实验(1)和(2)证明草酸晶体受热分解产生了CO和CO2。请写出草酸晶体受热分解的化学方程式 。
(4)为了测定某草酸溶液的物质的量浓度,该小组查阅文献发现硫酸酸化的高锰酸钾溶液可以氧化草酸并放出CO2,反应的离子方程式为 。若利用已知浓度的酸性高锰酸钾标准液滴定未知浓度的草酸溶液,滴定终点判断方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A. 充电时,电池的负极反应为LiC6-e-Li++C6
B. 放电时,电池的正极反应为CoO2+Li++e-LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉·坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就。屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法。右图为青蒿素,关于该物质的下列说法正确的是

A.青蒿素化学式为C15H20O5
B.在光照条件下可能发生取代反应
C.可以与氢气发生加成反应
D.水浸青蒿对治疗疟疾有良好的疗效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s |
1 | 0.10 | 丝 | 0.7 | 20 | 250 |
2 | 0.10 | 丝 | 1.0 | 20 | 200 |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式: ;
(2)①实验1、2可得出的结论是,硫酸浓度越 ,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越 ;
③实验3、4可得出的结论是温度越 ,反应速率越快。
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示。 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、 (GH)表示)最快时段是 。
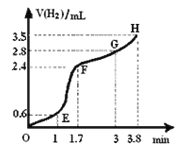
A.v (OE) B.v (EF) C.v (FG) D.v (GH)
②1min内反应较慢的原因是: ;
一段时间后反应明显加快的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O![]() NaClO3+H2↑(未配平)
NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3![]() 3KClO4+KCl,将产物分离得到KClO4。
3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为 L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是 。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)= mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com