
ЁОЬтФПЁПвбжЊЪЕбщЪвжЦШЁCl2ЕФЛЏбЇЗНГЬЪНЮЊЃК4HClЃЈХЈЃЉ + MnO2 ![]() MnCl2 + Cl2Ёќ + 2H2OЁЃЪдЛиД№ЯТСаЮЪЬтЃК
MnCl2 + Cl2Ёќ + 2H2OЁЃЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШчЭМЮЊжЦШЁCl2ЕФЗЂЩњзАжУЁЃ
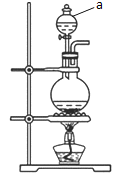
ЂйвЧЦїaЕФУћГЦЪЧ____ЃЛ
ЂквЧЦїaжаЪЂЗХЕФЪдМСЮЊ____ЃЛ
ЃЈ2ЃЉШчЭМЮЊCl2ЕФЪеМЏМАЮВЦјДІРэзАжУЁЃ
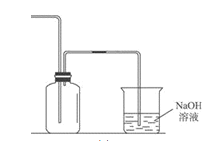
ЂйИУЦјЬхЪеМЏЗНЗЈЮЊ_____ЃЛ
A ЩЯХХПеЦјЗЈ B ЯТХХПеЦјЗЈ
ЂкЩеБжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
ЃЈ3ЃЉгћжЦЕУБъзМзДПіЯТ2.24L Cl2ЃЌжСЩйашвЊMnO2ЕФжЪСПЮЊ___gЁЃ
ЁОД№АИЁПЗжвКТЉЖЗ ХЈбЮЫсЛђHClЃЈХЈЃЉ A Cl2 + 2NaOH = NaCl + NaClO + H2O 8.7
ЁОНтЮіЁП
ЃЈ1ЃЉЂйИљОнзАжУЭМХаЖЯвЧЦїУћГЦЃЛ
ЂквЧЦїaзАвКЬхЪдМСЃЛ
ЃЈ2ЃЉЂйТШЦјЕФУмЖШБШПеЦјДѓЃЛ
ЂкЩеБжаЧтбѕЛЏФЦЮќЪеТШЦјЩњГЩТШЛЏФЦЁЂДЮТШЫсФЦКЭЫЎЃЛ
ЃЈ3ЃЉИљОнЗДгІЗНГЬЪНМЦЫуашвЊMnO2ЕФжЪСПЃЛ
ЃЈ1ЃЉЂйИљОнзАжУЭМПЩжЊЃЌвЧЦїaЪЧЗжвКТЉЖЗЃЛ
ЂквЧЦїaзАвКЬхЪдМСЃЌЫљвдвЧЦїaжаЪЂЗХЕФЪдМСЮЊХЈбЮЫсЃЛ
ЃЈ2ЃЉЂйТШЦјЕФУмЖШБШПеЦјДѓЃЌгУЯђЩЯХХПеЦјЗЈЪеМЏЃЌЙЪбЁAЃЛ
ЂкЩеБжаЧтбѕЛЏФЦЮќЪеТШЦјЩњГЩТШЛЏФЦЁЂДЮТШЫсФЦКЭЫЎЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧCl2 + 2NaOH = NaCl + NaClO + H2OЃЛ
ЃЈ3ЃЉБъзМзДПіЯТ2.24L Cl2ЕФЮяжЪЕФСПЪЧ![]() ЃЌЩшашвЊMnO2ЕФжЪСПЮЊx
ЃЌЩшашвЊMnO2ЕФжЪСПЮЊx
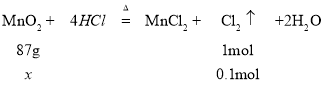
![]() 8.7gЁЃ
8.7gЁЃ


 вЛХЕЪщвЕЪюМйзївЕПьРжМйЦкдЦФЯУРЪѕГіАцЩчЯЕСаД№АИ
вЛХЕЪщвЕЪюМйзївЕПьРжМйЦкдЦФЯУРЪѕГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊдк1ЁС105 PaЁЂ298 KЬѕМўЯТЃЌ2 molЧтЦјШМЩеЩњГЩЫЎеєЦјЗХГі484 kJШШСПЃЌЯТСаШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧ(ЁЁЁЁ)
A.H2O(g)= H2(g)ЃЋ![]() O2(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
O2(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
B.2H2(g)ЃЋO2(g)= 2H2O(l)ЁЁІЄHЃНЃ484 kJЁЄmolЃ1
C.H2(g)ЃЋ![]() O2(g)= H2O(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
O2(g)= H2O(g)ЁЁІЄHЃН242 kJЁЄmolЃ1
D.2H2(g)ЃЋO2(g)= 2H2O(g)ЁЁІЄHЃН484 kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщгћдкЪЕбщЪвЬНОПТШЦјЕФаджЪМАФЃФтЙЄвЕжЦШЁЦЏАзЗлЃЌЩшМЦСЫШчЯТзАжУНјааЪЕбщЃК
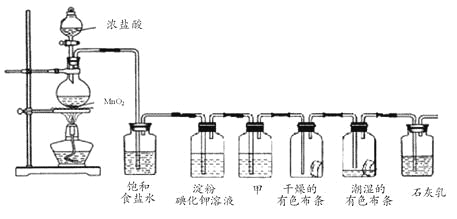
ЧыАДвЊЧѓЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕэЗлЕтЛЏМиШмвКжаЙлВьЕНЕФЯжЯѓЪЧ________________ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ_____________ЁЃ
ЃЈ2ЃЉШєИЩдяЕФгаЩЋВМЬѕВЛЭЪЩЋЃЌГБЪЊЕФгаЩЋВМЬѕЭЪЩЋЃЌдђМзжаЪЂЗХ________ЃЈЬюУћГЦЃЉЁЃ
ЃЈ3ЃЉC12гыЪЏЛвШщЗДгІжЦШЁЦЏАзЗлЕФЛЏбЇЗНГЬЪНЮЊ___________________________ЁЃ
ЃЈ4ЃЉИУаЫШЄаЁзщгУ8.7g MnO2гызуСПЕФХЈбЮЫсжЦБИТШЦјЃЌдђРэТлЩЯзюЖрПЩжЦЕУБъзМзДПіЯТЕФCl2____LЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЙизЂгЊбјЦНКтЃЌДйНјЩэаФНЁПЕЁЃДгЯТСаЫФжжЮяжЪжабЁдёЯргІзжФИДњКХЛиД№ЯТСаЮЪЬтЃК
A ьiУЙЫи B ЫЎ C НДгЭ D ЯЫЮЌЫи
ЂйЮЊзюживЊЕФПЙЩњЫиЃЌЪєгкЯћбзвЉЕФЪЧ____ЃЛ
ЂкФмДЬМЄГІЕРШфЖЏЃЌгажњгкЪГЮяЯћЛЏЕФЪЧ___ЃЛ
ЂлЮЊДйНјЬњЕФЮќЪеЃЌЮвЙњбЁдёзїЮЊЬњЧПЛЏЪГЮяЕФдиЬхЪЧ___ЃЛ
ЂмЪєгкШЫЬхЕФживЊзщГЩГЩЗжЃЌУПШЫУПЬьвЊВЙГф2.5~4.0LЕФЪЧ___ЁЃ
ЃЈ2ЃЉЬНЫїВФСЯЃЌЗсИЛЩњЛюЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЂйМвгУВЫЕЖЕФжївЊВФжЪЪЧгУ____ЃЛ
A ЬњКЯН№ B ТСКЯН№
ЂкЦћГЕТжЬЅЕФжївЊГЩЗжЪЧ___ЃЛ
A КЯГЩЯЫЮЌ B КЯГЩЯ№НК
ЂлДЋЭГЙшЫсбЮВњЦЗжївЊжИ____ЁЂЬеДЩКЭЫЎФрЁЃ
ЃЈ3ЃЉБЃЛЄЩњДцЛЗОГЃЌЮвУЧЖМдкааЖЏЁЃЧыЛиД№ЯТСаЮЪЬт:
Ђйе§ГЃгъЫЎЦЋЫсадЃЌpHдМЮЊ___ЃЛ
ЂкРћгУГСЕэЗДгІЪЧГ§ШЅЫЎжажиН№ЪєРызгЕФГЃгУЗНЗЈЁЃР§ШчЃЌЯђКЌHg2+ЕФЗЯЫЎжаМгШыNa2SЃЌПЩвдЪЙHg2+зЊЛЏЮЊГСЕэЖјГ§ШЅЁЃИУЗДгІЕФРызгЗНГЬЪНЮЊ_____ЃЛ
ЂлЮвЙњЁЖГЧЪаЩњЛюРЌЛјЗжРрБъжОЁЗжаЃЌДњБэЛиЪеБъжОЕФЪЧ_____ЃЛ
A  B
B 
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШмвКжаГ§ЬњЪБЛЙГЃгУNaClO3зїбѕЛЏМСЃЌдкНЯаЁЕФpHЬѕМўЯТзюжеЩњГЩвЛжжЧГЛЦЩЋЕФЛЦЬњЗЏФЦ[Na2Fe6(SO4)4(OH)12]ГСЕэГ§ШЅЁЃШчЭМЪЧЮТЖШ-pHгыЩњГЩЕФГСЕэЙиЯЕЭМЃЌЭМжавѕгАВПЗжЪЧЛЦЬњЗЏЮШЖЈДцдкЕФЧјгђЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉЃћвбжЊ25ЁцЃЌKsp[Fe(OH)3]=2.64ЁС10-39Ѓ§
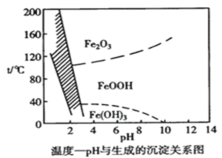
A.дк25ЁцЪБШмвКОбѕЛЏЃЌЕїНкШмвКpH=4ЃЌДЫЪБШмвКжаc(Fe3+)=2.64ЁС10-9molЁЄL-1
B.гУТШЫсФЦдкЫсадЬѕМўЯТбѕЛЏFe2+РызгЗНГЬЪНЮЊЃК6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
C.pH=6ЃЌЮТЖШДг80ЁцЩ§ИпжС150ЁцЬхЯЕЕУЕНЕФГСЕэБЛбѕЛЏ
D.ЙЄвЕЩњВњЛЦЬњЗЏФЦЃЌЮТЖШПижЦдк85ЁЋ95ЁцpH=1.5зѓгв
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)вбжЊЃК25 ЁцЁЂ101 kPaЪБЃЌC(s)ЃЋ1/2O2(g)=CO(g)ЁЁІЄH1ЃНЃ110.5 kJ/mol
C(s)ЃЋO2(g)=CO2(g)ЁЁІЄH2ЃНЃ393.5 kJ/mol
ЪдЛиД№ЯТСаЮЪЬтЃК
ЂйЬМЕФШМЩеШШЪЧЃК__________(ЬюЁАІЄH1ЁБЛђЁАІЄH2ЁБ)ЃЛ
ЂкCO(g)ЃЋ1/2O2(g)=CO2(g)ЁЁІЄHЃН__________kJ/molЁЃ
(2)дк25 ЁцЪБЃЌНЋ0.2 mol NO2ГфШы2 LЕФУмБеШнЦїжаЃЌЗЂЩњЗДгІЃК2NO2(g)![]() N2O4(g)ЁЁІЄHЃНЃ56.9 kJ/molЁЃ5УыКѓЗДгІДяЕНЦНКтЃЌВтЕУNO2ЕФЮяжЪЕФСПЮЊ0.1 molЁЃЪдЛиД№ЯТСаЮЪЬтЃК
N2O4(g)ЁЁІЄHЃНЃ56.9 kJ/molЁЃ5УыКѓЗДгІДяЕНЦНКтЃЌВтЕУNO2ЕФЮяжЪЕФСПЮЊ0.1 molЁЃЪдЛиД№ЯТСаЮЪЬтЃК
Ђй5УыФкЃЌv(NO2)ЃН__________mol/(LЁЄs)ЃЛ
ЂкШєНЋИУШнЦїжУгкБљЫЎжаЃЌЦјЬхбеЩЋНЋ________(ЬюЁАБфЩюЁБЁАБфЧГЁБЛђЁАВЛБфЁБ)ЃЛ
ЂлИУЗДгІЕФЦНКтГЃЪ§БэДяЪНKЃН________________ЁЃ
(3)NaHSO3ЪЧжабЇЛЏбЇГЃМћЕФЮяжЪЁЃHSO3-дкЫЎШмвКжаДцдкШчЯТСНИіЦНКтЃК
HSO3-=HЃЋЃЋSO32-ЁЁKa2
HSO3-ЃЋH2O=H2SO3ЃЋOHЃЁЁKh2
вбжЊ25 ЁцЪБЃЌKa2>Kh2ЃЌдђ0.1 mol/L NaHSO3ШмвКЃК
ЂйШмвКГЪ__________(ЬюЁАЫсадЁБЁАМюадЁБЛђЁАжаадЁБ)ЃЛ
ЂкШмвКжаc(NaЃЋ)______c(HSO3-)(ЬюЁА>ЁБЁА<ЁБЛђЁАЃНЁБ)ЁЃ
(4)НЋГ§атКѓЕФЬњЖЄгУБЅКЭЪГбЮЫЎНўХнвЛЯТЃЌЗХШыЯТЭМЫљЪОЕФОпжЇЪдЙмжаЁЃ

ЂйМИЗжжгКѓЃЌПЩЙлВьЕНЕМЙмжаЕФЫЎжљ________ЃЛ
AЃЎЩ§Ип BЃЎНЕЕЭ
ЂкЫЎжљБфЛЏЕФдвђЪЧЬњЖЄЗЂЩњСЫЕчЛЏбЇИЏЪДжаЕФ________ЃЛ
AЃЎЮіЧтИЏЪД BЃЎЮќбѕИЏЪД
ЂлИУЕчЛЏбЇИЏЪДЕФе§МЋЗДгІЪНЮЊ__________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбЇЯАаЁзщЮЊСЫЬНОПЬМгыХЈH2SO4ЗДгІЕФВњЮяЃЌНЋХЈH2SO4КЭФОЬПЗДгІВњЩњЕФЦјЬхНјаавдЯТЪЕбщЃК
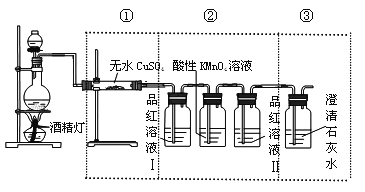
(1)ЦјЬхЭЈЙ§ЮоЫЎСђЫсЭЃЌЙЬЬхБфРЖЁЃЫЕУїЦјЬхжаКЌга__________ЃЛ
(2)ЦјЬхЭЈШыЦЗКьШмвКЃЌШмвКЭЪЩЋЃЛЮЂШШЃЌШмвКЛжИДКьЩЋЁЃЫЕУїЦјЬхжаКЌга__________(ЬюЁАSO2ЁБЛђЁАCO2ЁБ)ЃЛ
(3)ЦјЬхЭЈШызуСПЕФГЮЧхЪЏЛвЫЎЃЌВњЩњАзЩЋГСЕэЁЃИУаЁзщШЯЮЊЦјЬхжаКЌгаCO2ЃЌФуШЯЮЊИУНсТлЃК__________(ЬюЁАе§ШЗЁБЛђЁАВЛе§ШЗ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКЌга0.6molCl-ЁЂ0.8 molSO42-МАвЛЖЈСПMg2+КЭAl3+ЕФЛьКЯШмвКжаЃЌЕЮШывЛЖЈХЈЖШNaOHШмвКЃЌВњЩњГСЕэЧщПіШчЭМЃЈВЛПМТЧMg2ЃЋКЭAl3ЃЋЫЎНтМАЫЎЕчРыЖдРызгЪ§ФПЕФгАЯьЃЉЁЃШєЗДгІЧАAl3+ЕФЮяжЪЕФСПЮЊa molЃЌAl3ЃЋЕФЮяжЪЕФСПгыЛьКЯШмвКжаРызгзмЮяжЪЕФСПЕФБШжЕЮЊxЁЃдђ
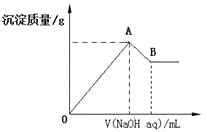
A.x=![]()
B.xЕФШЁжЕЗЖЮЇЪЧ0ЃМx<11/32
C.AЕуКсзјБъЕФжЕЫцxЗЂЩњБфЛЏ
D.ШєBЕуКсзјБъЮЊ200mLЪБЃЌc(NaOH)=7.0mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкжїзхдЊЫиXЁЂYЁЂZЁЂWЕФдзгађЪ§вРДЮдіДѓЃЌXгыЦфЫћдЊЫиОљВЛдкЭЌжмЦкЃЌWЕФMВуЕчзгЪ§ЪЧKВуЕФ2.5БЖЃЌZX2ЪЧвЛжжДЂЧтВФСЯЃЌвКЬЌYЕФМђЕЅЧтЛЏЮяПЩгУзїжЦРфМСЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
A.ЗЧН№ЪєадЃКY>W
B.ЕШЮяжЪЕФСПЕФW4гыCH4ЙВМлМќЪ§ФПВЛЭЌ
C.XЁЂYЕФЕЅжЪдкДпЛЏМСзїгУЯТЛЏКЯЕФЙ§ГЬПЩвдБэЪОЮЊЃК![]()
D.ZЕФЕЅжЪдкПеЦјжаШМЩеЛсЩњГЩZ3Y2
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com