
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是

A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.溶液中 SO42-向负极移动
C.铜为阳极,锌为阴极
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

A.该反应的化学方程式为:3Z=3X+2Y
B.t时,X、Y、Z的质量不再改变
C.t时,Z的浓度为1.2mol/L
D.t时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。其部分合成工艺如下:
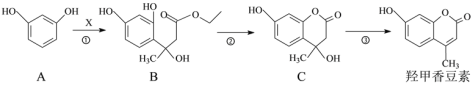
(1)已知![]() 不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
(2)反应①、②的反应类型分别为________、________。
(3)下列有关说法正确的是________。
A.化合物B和C分子各含有1个手性碳原子
B.化合物C能发生加成反应、取代反应和消去反应
C.1 mol羟甲香豆素最多可与2 mol NaOH反应
(4)写出满足下列条件的化合物C的一种同分异构体的结构简式________。
①能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有2种不同化学环境的氢
(5)反应③的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是合成新农药的重要中间体。以化合物A为原料合成化合物G的工艺流程如下:

(1)化合物G中含氧官能团的名称为________。
(2)反应D→E的反应类型为________。
(3)化合物B的分子式为C7H6Cl2,B的结构简式为______。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①能发生银镜反应;
②核磁共振氢谱显示氢原子的峰值比为3∶2∶2∶1。
(5)请以化合物F和CH2(COOC2H5)2为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3.工艺流程如下:

回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为___________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________________。
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为_______________。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种氧化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
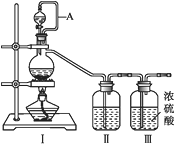
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ① | ② |
制备纯净NO | Cu | ③ | ④ |
②___________,③___________。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→___________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅶ的作用为________________,若无该装置,Ⅸ中NOCl可能发生反应的化学方程式为_______________________________。
③乙组同学认为氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,所以装置Ⅷ不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是__________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为___________________。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度
取Ⅸ中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
②若滴定前,滴定管尖嘴有气泡,滴定后气泡消失,则所测亚硝酰氯的纯度_________(偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 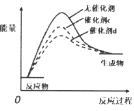 催化剂活性
催化剂活性![]()
B. 
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D.  向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com