
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3.工艺流程如下:

回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为___________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________________。
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为_______________。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)

【答案】33 ![]() 与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS33-(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、铁氰化钾(或稀硫酸、高锰酸钾) AsO33-+I2+2OH-=2I-+3AsO43-+H2O 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O SO2
与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS33-(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、铁氰化钾(或稀硫酸、高锰酸钾) AsO33-+I2+2OH-=2I-+3AsO43-+H2O 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O SO2
【解析】
酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,结合氧化还原反应的规律分析解答。
(1)砷元素与N同一主族,为第四周期第VA族元素,砷元素的原子序数为7+8+18=33,Na2S属于离子化合物,电子式为![]() ,故答案为:33;
,故答案为:33;![]() ;
;
(2)亚铁离子与过量的S2-结合生成FeS沉淀,使As2S3+3S2-2AsS32-平衡逆向进行,提高沉砷效果,防止As2O3与S2-结合生成AsS33-,故答案为:与过量的S2-结合生成FeS沉淀,防止AS2O3与S2-结合生成AsS33-;
(3)四氧化三铁含有+2价铁,具有还原性,可在酸性条件下与高锰酸钾反应,溶液褪色,则可用硫酸、高锰酸钾检验,也可以用稀硫酸溶解后用铁氰化钾检验,故答案为:稀硫酸、高锰酸钾溶液(或稀硫酸、铁氰化钾);
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化AsO33-,反应的离子方程式为AsO33-+I2+2OH-=2I-+3AsO43-+H2O,故答案为:AsO33-+I2+2OH-=2I-+3AsO43-+H2O;
(5)调节pH=0时,二氧化硫与Na3AsO4制备As2O3的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,故答案为:2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O;
(6)As4S4中As为+2价、S为-2价,反应生成As2O3,As为+3价,则1molAs4S4参加反应时,转移28mole-,其中As化合价升高4×1=4,转移4mol电子,则4molS转移24mol电子,S元素化合价升高6价,则生成物中S的化合价为+4价,应为SO2,故答案为:SO2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如下图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。回答下列问题。

(1)氢氧燃料电池的能量转化主要形式是_______________________________;导线中电子流动方向为______________________(用a、b表示)。
(2)负极反应式_______________________________________________________。
(3)电极表面镀铂粉的原因____________________________________________。
(4)KOH溶液pH的变化___________(填“变大”“变小”或“不变”)。
(5)关于氢氧燃料电池,下列说法不正确的是___________。
①燃料电池的能量转化可达100%
②是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置
③氢氧燃料电池组合成燃料电池发电站,被人们誉为“绿色”发电站
④如果电池使用酸性电解质,负极反应式为:H2-2e-=2H+
(6)如果以N2 和H2 为反应物,以溶有A的稀盐酸为电解质溶液,可研发出既能提供电能又能固氮的新型电池,装置如下图所示。

①指出该电池的正极___________(用a、b表示)。
②物质A的化学式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中7种短周期元素的有关信息判断,下列说法错误的是![]()
![]()
元素编号 |
|
|
|
|
|
|
|
原子半径 |
|
|
|
|
|
|
|
最高化合价或最低化合价 |
|
|
|
|
|
|
|
A. 元素![]() 气态氢化物的稳定性大于元素
气态氢化物的稳定性大于元素![]() 气态氢化物的稳定性
气态氢化物的稳定性
B. 元素![]() 氢化物的沸点小于元素
氢化物的沸点小于元素![]() 氢化物的沸点
氢化物的沸点
C. 元素![]() 形成的化合物具有两性
形成的化合物具有两性
D. ![]() 可形成离子化合物
可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是

A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______;B______;C______;D______
(2)D元素位于周期表中______周期______族.![]() 的电子式:______,所含化学键______
的电子式:______,所含化学键______
(3)![]() 的电子式______写出
的电子式______写出![]() 与
与![]() 反应的化学方程式______
反应的化学方程式______
(4)任写一个与B的简单离子所含电子数相同的分子______
(5)电子式表示化合物![]() 的形成过程:______
的形成过程:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:
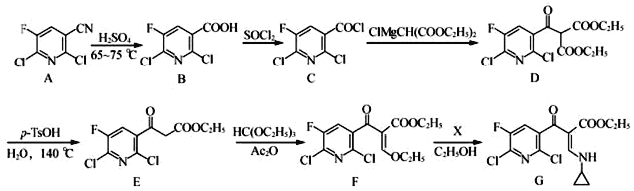
(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)E到F过程中的反应物HC(OC2H5)3中最多有_____个碳原子共面。
(5)B和乙醇反应的产物为H(C8H6FCl2NO2),写出该反应的化学方程式_______________ 。
写出满足下列条件的H的所有同分异构体的结构简式:_____________。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(6)根据已有知识并结合相关信息,写出以 ![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )

A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.Q位于第三周期ⅠA族
B.Z与M的氧化物对应水化物均为强酸
C.简单离子半径:M>R2+>Q+
D.X、Y、Z三种元素组成的化合物可能含有离子键和共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com