
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
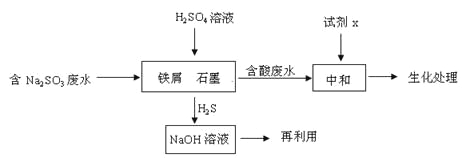
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
【答案】S2-+ H2O![]() HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
【解析】
(1)某制革厂含硫废水中主要含有的物质是Na2S,
①Na2S属于强碱弱酸盐,S2-水解使溶液呈碱性,水解的离子方程式表示为:S2-+ H2O![]() HS-+ OH-;
HS-+ OH-;
②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,根据得失电子守恒,还原剂与氧化剂的物质的量之比为1:2;温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,即△H>0;
(2)①中和含酸废水工业常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O;
③SO32-在酸性条件下放电生成H2S的过程为得电子的还原反应,电极反应式为SO32-+8H++6e-=H2S↑+3H2O;
④已知:①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol,
②SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol,
利用盖斯定律将①-②×2可得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=(-632.8kJ/mol)-2×(+269.8kJ/mol)=-1172.4kJ/mol,所以热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
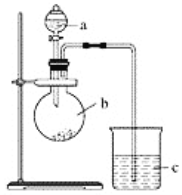
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。甲同学设计该实验的目的是_________________,反应最剧烈的烧杯是________(填字母),结论是__________,原因(从本质上解释)______________。
(2)乙同学想验证同周期元素金属性强弱的规律,最好选用第________周期的________三种元素(填元素名称)。最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象。解释:___________________。写出钠和水反应的离子方程式__________________________
(3)丙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了如图的装置以验证氮、碳、硅元素的非金属性强弱。丙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
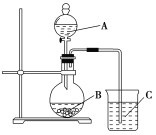
①写出所选用物质的化学式:A:________,B:________,C:________。
②写出烧杯中发生反应的离子方程式:_________________。
③该实验存在的问题是___________________,改进措施为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
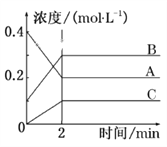
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
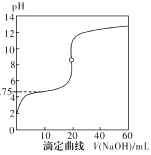
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com