
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构与性质)“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________(填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为________________。
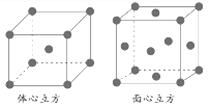
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
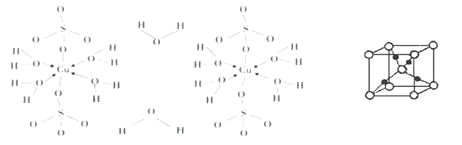
①写出基态Cu2+的核外电子排布式_______。
②胆矾中含有的粒子间作用力是_______(填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
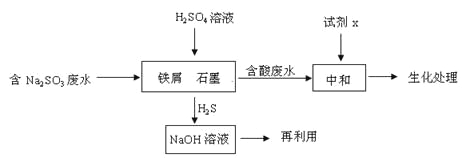
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是( )
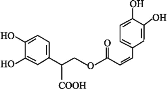
A.迷迭香酸的分子式为:C17H15O8
B.1 mol迷迭香酸最多能与9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1 mol迷迭香酸最多能与含5 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应产物中,有的同时生成多种同分异构体,有的则没有。其中一定不存在同分异构体的反应是:
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2—氯丁烷(![]() )与NaOH乙醇溶液共热发生消去反应
)与NaOH乙醇溶液共热发生消去反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.![]() 邻羟基苯甲酸与NaHCO3溶液反应
邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知mX(g)+nY(g)![]() gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___。
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
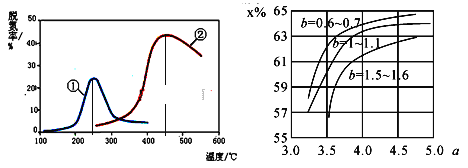
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______。
②以下说法正确的是_________。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com