
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
【答案】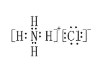 4 正四面体 ⅠB
4 正四面体 ⅠB 
![]() 3d9 Cu+ 因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定 3:5 sp2杂化 N>O>C
3d9 Cu+ 因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定 3:5 sp2杂化 N>O>C
【解析】
(1)铵根中氮原子与每个氢原子共用一对电子,故电子式为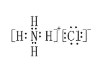 ;N的价层电子对数为4+
;N的价层电子对数为4+![]() ×(5-1-4×1)=4,由于没有孤电子对,所以空间构型为正四面体,故答案为:
×(5-1-4×1)=4,由于没有孤电子对,所以空间构型为正四面体,故答案为: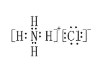 ;4;正四面体;
;4;正四面体;
(2)第四周期第11列为第ⅠB族,为第29号元素,即Cu元素,核电荷数为29,核外有29个电子,它的基态原子结构示意图为 ,核外电子排布为:1s22s22p63s23p63d104s1;Cu+为铜原子失去最外层一个电子形成,所以价层电子排布图为
,核外电子排布为:1s22s22p63s23p63d104s1;Cu+为铜原子失去最外层一个电子形成,所以价层电子排布图为![]() ;Cu2+为铜原子失去4s一个电子和3d一个电子形成,所以价层电子排布为3d9;轨道全满或半满状态比较稳定所以亚铜离子比铜离子稳定,故答案为:ⅠB;
;Cu2+为铜原子失去4s一个电子和3d一个电子形成,所以价层电子排布为3d9;轨道全满或半满状态比较稳定所以亚铜离子比铜离子稳定,故答案为:ⅠB; ;
; ![]() ;3d9; Cu+;因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定;
;3d9; Cu+;因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定;
(3)乙炔分子含有3个σ键,乙烯分子含有5个σ键,它们的σ键个数之比为3:5,乙烯分子中一个C的价层电子对数为![]() ,所以杂化类型为sp2杂化;C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第ⅤA族的大于相邻的第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:3:5;sp2杂化;N>O>C;
,所以杂化类型为sp2杂化;C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第ⅤA族的大于相邻的第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:3:5;sp2杂化;N>O>C;


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构与性质)“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________(填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为________________。
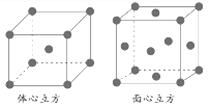
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
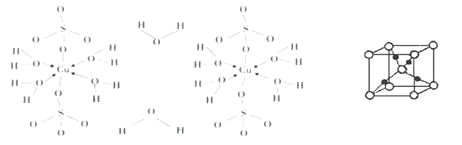
①写出基态Cu2+的核外电子排布式_______。
②胆矾中含有的粒子间作用力是_______(填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
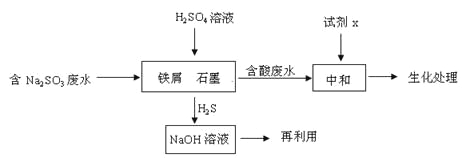
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应产物中,有的同时生成多种同分异构体,有的则没有。其中一定不存在同分异构体的反应是:
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2—氯丁烷(![]() )与NaOH乙醇溶液共热发生消去反应
)与NaOH乙醇溶液共热发生消去反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.![]() 邻羟基苯甲酸与NaHCO3溶液反应
邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验
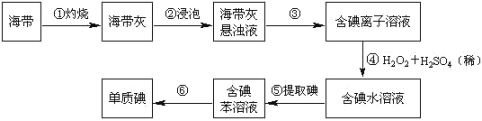
(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(______)(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____;步骤⑤的实验操作名称是_____。
(3)步骤⑤中应充分振荡,然后静置,待分层后(______)(填标号)
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4) ④过程的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com