
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验
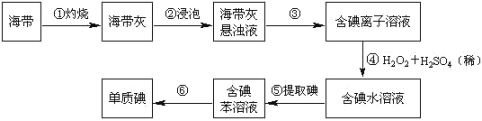
(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(______)(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____;步骤⑤的实验操作名称是_____。
(3)步骤⑤中应充分振荡,然后静置,待分层后(______)(填标号)
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4) ④过程的离子方程式_____。
【答案】BDE 过滤 萃取、分液 D 2I- +H2O2+ 2H+ = I2+ 2H2O
【解析】
由实验流程可知,海带在坩埚中灼烧后溶解,然后过滤得到含碘离子的溶液,④中发生氧化还原反应生成碘单质,⑤发生萃取得到含碘的有机溶液,⑥蒸馏得到碘单质。
(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,故答案为:BDE;
(2)海带在坩埚中灼烧后溶解,然后过滤得到含碘离子的溶液,所以步骤③的实验操作名称是过滤;发生萃取得到含碘的有机溶液,⑤的实验操作名称是萃取、分液,故答案为:过滤;萃取、分液;
(3)步骤⑤是萃取、分液,苯来提取碘的理由是碘在苯中的溶解度大于在水中的溶解度,且苯和水不互溶、和碘水不反应;在分液操作中,应充分振荡,然后静置,待分层后先将水层(密度大于苯,在下层)从分液漏斗的下口放出,再将含碘苯溶液从上口倒出,选D;故答案为:D。
(4)④中发生氧化还原反应生成碘单质,在酸性条件下,过氧化氢氧化碘负离子的离子反应方程式为:2I- +H2O2+ 2H+ = I2+ 2H2O,故答案为:2I- +H2O2+ 2H+ = I2+ 2H2O。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
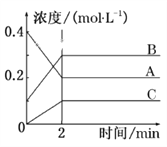
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式:____________________________________________
能说明醋酸是弱电解质的事实是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃X是一种重要的有机化工原料,相对分子质量为92。以它为初始原料可以获得如下图的系列有机产物![]() 部分产物、合成路线、反应条件略去
部分产物、合成路线、反应条件略去![]() ,H是一种功能高分子。
,H是一种功能高分子。
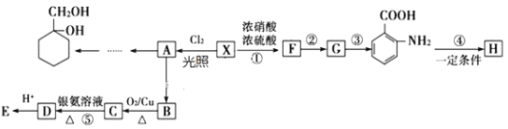
已知: I. ![]()
![]()
![]()
II.![]()
![]()
![]()
![]() 苯胺,易被氧化
苯胺,易被氧化![]()
请根据所学知识与本题所给信息回答问题:
(1)F的名称为_______。A共平面的原子数最多为_____个。
(2)反应![]() 的类型是 _______ 。
的类型是 _______ 。
(3)H含有的官能团名称为 _________ 。
(4)反应![]() 的化学方程式是 _________ 。
的化学方程式是 _________ 。
(5)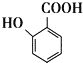 有多种同分异构体,其中能发生银镜反应且能使FeCl3溶液显紫色的有机物有___种。
有多种同分异构体,其中能发生银镜反应且能使FeCl3溶液显紫色的有机物有___种。
(6)写出用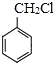 和其他无机化合物合成
和其他无机化合物合成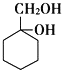 的合成线路_____________。
的合成线路_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取铁的流程如图:

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是__________(填“加快”或“减慢”)反应速率,写出浸取过程中的化学反应方程式:____________________________。
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为____________(填“蒸发”或“过滤”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于______(填“热还原法”或“电解法”)。
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2![]() 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________molL-1min-1。
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________molL-1min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
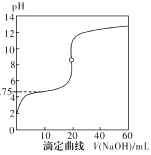
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3A1F6)白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na2AlF6的装置图如下(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑

(1)实验仪器不能使用玻璃仪器的原因是_____________(用化学方程式表示)。
(2)装置III的作用为______________________。
(3)在实验过程中,装置II中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子反应方程式:__________________。
(4)在实验过程中,先向装置II中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和A1(OH)3混合后再通入HF气体,其原因是_______________。 .
(5)装置II反应后的混合液经过过滤可得到Na3A1F6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是_____________________。
(6)在电解制铝的工业生产中,阳极的电极反应式为_____________。
(7)萤石中含有少量的Fe2O3杂质,可用于装置I反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0 g萤石加入装置I中,完全反应后,将混合液加稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定,当出现_________现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为______________。(已知:I2+2S2O32-==S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。三氯硅烷(SiHCl3)还原法是目前工业制高纯度硅的主要方法,生产过程如下图:
![]()
根据题意完成下列备题:
(1)硅在元素周期表的位置____________,其最外层有____________种能量不同的电子。
(2)硅的气态氢化物为SiH4,其空间构型为____________;三氯硅烷中某些元素最高价氧化物对应水化物的酸性____________![]() ____________
____________![]() 填化学式
填化学式![]() 。
。
(3)写出三氯硅烷与氢气反应的化学反应方程式:____________。
(4)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成。如正长石(KAlSi3O8),氧化物形式为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com