
【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1
【答案】EGIK
【解析】
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式除热能之外,还有电能、光能等形式,故A错误;
B.同温同压下,对同一个反应而言反应热是保持不变的,与反应的条件无关,因此反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同,故B错误;
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,石墨转变成金刚石是吸热反应,金刚石的能量高于石墨的能量,物质的能量越高越不稳定,故石墨比金刚石稳定,故C错误;
D.物质的状态不同能量不同,等量相同物质的气态能量>液态能量>固态能量,因此水的能量高于等质量的冰的能量,故D错误;
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。而2mol氢原子结合成氢分子的过程是形成化学键的过程,成键过程是放热过程,因此2E1>E2,故E正确;
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂不可以是浓溶液,因浓溶液在稀释过程中伴随着能量变化会影响中和热的测定数值,故F错误;
G.1molNaOH分别和1molCH3COOH、1molHNO3反应均产生1mol液态水和相应的盐,但是醋酸在反应过程中逐步电离,电离是吸热过程,导致放热量偏少,放出的热量:CH3COOH<HNO3故G正确;
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液会使溶液体积增加,盐酸的浓度减小,速率减小,故H错误;
I.可逆反应,反应进行的净速率是正、逆反应速率之差正确,故I正确;
J.对于可逆反应,在平衡建立过程中,正反应速率在逐渐减小,逆反应速率在逐渐增大,正逆反应速率的比值在改变,故J错误;
K.探究温度对反应速率的影响时,控制其他变量相同,只控制温度不同,则应将混合物分别在热水、冷水中反应,故K正确;
L.苯中不存在典型的碳碳单键和碳碳双键,因此根据表格中的数据无法确定苯中碳碳键的键能大小,也就无法计算该反应的反应热,故L错误。
因此正确的有:EGIK
故答案为:EGIK


科目:高中化学 来源: 题型:
【题目】已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置(省略夹持装置及加热装置)可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是 ( )
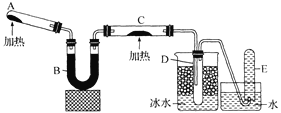
A.试管A中加入的试剂为NH4Cl固体
B.反应中氧化剂和还原剂的物质的量之比为2 : 3
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中所含碘元素以碘离子(I-)的形式存在,经常食用海带可以防治甲状腺肿大。某同学设计实验从海带中提取碘,有如下操作:①滤液中滴加稀硫酸和双氧水;②在海带中加入少量酒精,使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液;⑥蒸馏。下列说法不正确的是( )
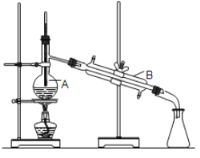
A.实验的合理操作顺序是②④①③⑤⑥
B.步骤②、④中都需要用到玻璃棒
C.步骤①中双氧水表现氧化性
D.通常用如图所示装置蒸馏,产品中易混有高沸点杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1molCl2与足量Fe反应转移电子数一定为3NA
B. 标准状况下,2.24LNH3中含有共价键的数目为NA
C. 标况下,11.2LSO3所含的分子数目为0.5NA
D. lmolNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是
中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ![]()
![]()
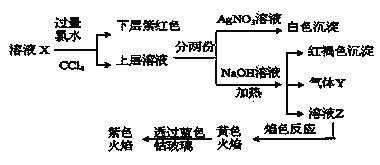
A.该溶液X中可能有![]() 、
、![]()
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有![]()
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在![]() 、
、![]() 中的某一种
中的某一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、V、W、X、Y、Z六种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;M元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。V的单质在空气中含量最高。回答下列问题:
(1)M的一种核素中质子数为中子数的![]() ,则该核素的名称为__。
,则该核素的名称为__。
(2)Z的元素符号为__。
(3)X元素的单质与Z的最高价氧化物对应的水化物反应的离子反应方程式为__。
(4)Y的单质在加热条件下与铁反应的化学方程式为__。
(5)非金属性W__Y(填大于或小于)
(6)用一个方程式证明W和Y的非金属性强弱__。
(7)实验室中,V的最高价氧化物对应的水化物可用Y的最高价氧化物对应的水化物制得,写出相应的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:

已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com