
【题目】有M、V、W、X、Y、Z六种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;M元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。V的单质在空气中含量最高。回答下列问题:
(1)M的一种核素中质子数为中子数的![]() ,则该核素的名称为__。
,则该核素的名称为__。
(2)Z的元素符号为__。
(3)X元素的单质与Z的最高价氧化物对应的水化物反应的离子反应方程式为__。
(4)Y的单质在加热条件下与铁反应的化学方程式为__。
(5)非金属性W__Y(填大于或小于)
(6)用一个方程式证明W和Y的非金属性强弱__。
(7)实验室中,V的最高价氧化物对应的水化物可用Y的最高价氧化物对应的水化物制得,写出相应的化学反应方程式___。
【答案】氚 K 2Al+2OH-+2H2O=2AlO2-+3H2↑ Fe+S![]() FeS 大于 2H2S+O2
FeS 大于 2H2S+O2![]() 2S+2H2O NaNO3+H2SO4(浓)
2S+2H2O NaNO3+H2SO4(浓)![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
【解析】
M元素的一种核素原子核内无中子,推知M为氢元素;V的单质在空气中含量最高,是氮气,推知V为氮元素;W元素原子L层电子数是K层电子数的3倍,推知W为氧元素;W和Y元素原子的最外层电子数相同,推知Y元素为硫元素;X元素原子的最外层电子数是Y元素原子最外层电子数的一半,推知 X为铝元素;Z元素原子的最外层只有一个电子,Z是金属元素,且在六种元素中序数最大,说明是第IA族元素,所以推知Z为钾元素。
(1)由分析可知M为氢元素,它的的三种同位素分别为质量数为1、2、3的核素,名称分别为氕、氘、氚,质子数为中子数的![]() ,说明中子数为2则质量数为3,故答案为氚;
,说明中子数为2则质量数为3,故答案为氚;
(2)由分析知Z为钾元素,元素符号为K,故答案为:K;
(3)X元素的单质为Al, Z的最高价氧化物对应的水化物为氢氧化钠,二者反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)Y的单质为硫,氧化性较弱,在加热条件下与铁反应只能生成硫酸亚铁,其反应的化学方程式为Fe+S![]() FeS ,故答案为:Fe+S
FeS ,故答案为:Fe+S![]() FeS;
FeS;
(5)由分析知W为氧元素,Y为硫元素,非金属性O大于S,故答案为:大于;
(6)非金属性强的元素对应的单质的氧化性强,可以将非金属性弱的元素从对应的化合物中置换出来,所以证明氧元素和硫元素的非金属性强弱可以通过氧气与硫化氢发生置换反应来证明,故答案为:2H2S+O2![]() 2S+2H2O;
2S+2H2O;
(7)浓硫酸难挥发,可用来制备易挥发性的酸,硝酸为易挥发性的酸,所以可以通过浓硫酸与硝酸盐反应来制备硝酸,其反应的化学反应方程式为NaNO3+H2SO4(浓)![]() NaHSO4+HNO3↑,故答案为:NaNO3+H2SO4(浓)
NaHSO4+HNO3↑,故答案为:NaNO3+H2SO4(浓)![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑


科目:高中化学 来源: 题型:
【题目】在中和热测定的实验中,以下操作正确的是:( )
①只在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平,再盖上硬纸板
②温度计测量过盐酸的温度后,立即插入![]() 溶液中测量
溶液中测量![]() 溶液的温度
溶液的温度
③将量筒中的![]() 溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
④读取混合溶液的最高温度和最低温度,以其平均值记为最终温度.
A.只有①正确B.只有②正确
C.只有①④正确D.都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 用铜电极电解硫酸铜溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-==2BaSO4↓+Al(OH)3↓+NH3·H2O
C. 偏铝酸钠溶液中通入过量的二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O==Fe(OH)2↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质在相应的横线上。
品名 | ××× |
配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
保质期 | 240天 |
生产日期 | 标于包装袋袋封口上 |
(1)富含蛋白质的物质是___________________________;
(2)富含糖类的物质是____________________________;
(3)富含油脂的物质是____________________________;
(4)富含维生素的物是___________________________。
Ⅱ.钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极式为:负极________________;正极_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种直接铁燃料电池(电池反应为:3Fe + 2O2=Fe3O4)的装置如图所示,下列说法正确的是
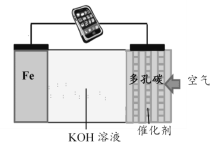
A. Fe极为电池正极
B. KOH溶液为电池的电解质溶液
C. 电子由多孔碳极沿导线流向Fe极
D. 每5.6gFe参与反应,导线中流过1.204×1023个e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
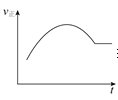
A.绝热恒容密闭容器中通入A和B,发生反应:2A(g)+B(g)2C(g),图为其正反应速率随时间变化的示意图,则该反应为放热反应
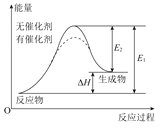
B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率如图显示的是催化反应与无催化反应过程中的能量关系
C.将BaO2放入密闭真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的一半,体系重新达到平衡,体系压强变化如图所示

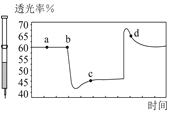
D.将一定量的NO2充入针筒中后封口,发生反应2NO2(g)N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化气体颜色越深,透光率越小。则c点与a点相比,c(NO2)增大,减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色高效水处理剂.某学习小组用图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4.

查阅资料知K2FeO4的部分性质如下:
①溶于水、微溶于浓KOH溶液
②在0℃~5℃、强碱性溶液中比较稳定
③Fe3+和Fe(OH)3催化作用下发生分解
④酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2.
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是__.
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3.为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是__.
(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式__.
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质.
提纯方案:
将一定量的K2FeO4粗产品溶于冷的3mol/L KOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥.
第一次和第二次过滤得到的固体分别对应的是(填化学式)__、__,过滤时不用普通漏斗而采用砂芯漏斗的原因是(用离子方程式说明)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
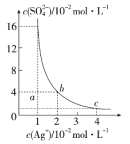
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(molL-1)3
D.0.02molL-1的AgNO3溶液与的0.2molL-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com