
【题目】Ⅰ.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质在相应的横线上。
品名 | ××× |
配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
保质期 | 240天 |
生产日期 | 标于包装袋袋封口上 |
(1)富含蛋白质的物质是___________________________;
(2)富含糖类的物质是____________________________;
(3)富含油脂的物质是____________________________;
(4)富含维生素的物是___________________________。
Ⅱ.钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极式为:负极________________;正极_____________。
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③使用催化剂,ΔH3减小
C.反应CH3OH(g)=![]() CH3OCH3(g)+
CH3OCH3(g)+![]() H2O(l)的ΔH<
H2O(l)的ΔH<![]() kJ·mol-1
kJ·mol-1
D.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是
中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ![]()
![]()
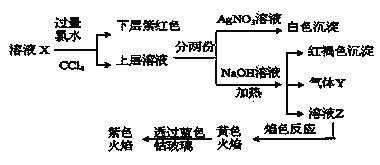
A.该溶液X中可能有![]() 、
、![]()
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有![]()
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在![]() 、
、![]() 中的某一种
中的某一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚀刻铜制线路板的蚀刻液种类很多:酸性蚀刻液,如![]() 蚀刻溶液、H2O2-盐酸及CuCl2-盐酸
蚀刻溶液、H2O2-盐酸及CuCl2-盐酸![]() 碱性蚀刻液,如
碱性蚀刻液,如![]() 溶液等。回答下列问题:
溶液等。回答下列问题:
(1)写出下列蚀刻液蚀刻铜的离子方程式。
①FeCl3溶液:_______。
②H2O2-盐酸:_______。
③![]() 溶液:_______
溶液:_______![]() 生成
生成![]() 。
。
(2)利用废![]() 蚀刻液
蚀刻液![]() 含
含![]() 、
、![]() 及
及![]() 制备碱性蚀刻液
制备碱性蚀刻液![]() 溶液和
溶液和![]() 的主要步骤包括:用
的主要步骤包括:用![]() 氧化废蚀刻液,通入氨气
氧化废蚀刻液,通入氨气![]() ,固液分离,用盐酸溶解沉淀和
,固液分离,用盐酸溶解沉淀和![]() 的制备。下列实验装置不能达到实验目的的是_______
的制备。下列实验装置不能达到实验目的的是_______![]() 填字母
填字母![]() 。
。
A. 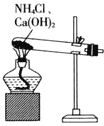 制备
制备![]()
B. 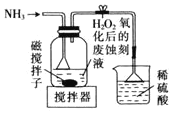 制备
制备![]() 并沉铁
并沉铁
C. 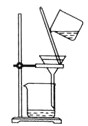 分离
分离![]() 溶液和
溶液和![]() 沉淀
沉淀
D.  将
将![]() 溶液蒸干制备
溶液蒸干制备![]()
(3)常用水合肼![]() 还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
(4)文献报道一种回收蚀刻废液中铜并制取胆矾![]() 的主要工艺流程如下:
的主要工艺流程如下:
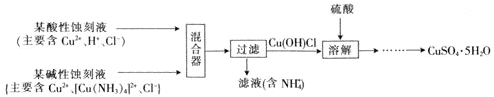
已知:![]() 易与酸反应。
易与酸反应。
![]() 在混合器中,
在混合器中,![]() 的离子方程式为_______。
的离子方程式为_______。
![]() 溶于硫酸的离子方程式为_______。
溶于硫酸的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、V、W、X、Y、Z六种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;M元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。V的单质在空气中含量最高。回答下列问题:
(1)M的一种核素中质子数为中子数的![]() ,则该核素的名称为__。
,则该核素的名称为__。
(2)Z的元素符号为__。
(3)X元素的单质与Z的最高价氧化物对应的水化物反应的离子反应方程式为__。
(4)Y的单质在加热条件下与铁反应的化学方程式为__。
(5)非金属性W__Y(填大于或小于)
(6)用一个方程式证明W和Y的非金属性强弱__。
(7)实验室中,V的最高价氧化物对应的水化物可用Y的最高价氧化物对应的水化物制得,写出相应的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象。
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
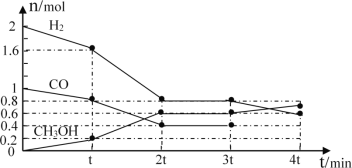
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=__。
②tmin至2tmin时速率变化的原因可能是__(要求答出所有可能原因)。
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的![]() 。请回答下列问题:
。请回答下列问题:
①SO2的转化率为__;
②达到平衡时反应放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。科学家研发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成氢气,其工作原理如图所示。下列有关说法不正确的是( )
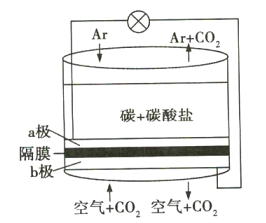
A.a极通Ar气的目的是增强导电能力
B.a极的电极反应式为![]()
C.电流由b极沿导线经负载再流向a极
D.![]() 由b极区透过隔膜流向a极区
由b极区透过隔膜流向a极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
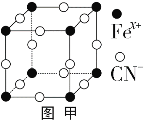
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
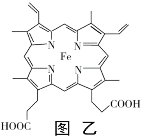
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________

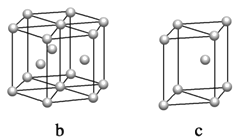
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com