
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJmol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJmol-1
H2O(l)=H2O(g) △H=+44kJmol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的△H=_________
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
①还原产物的化学式为_________
②配平后的化学方程式是__________________

(4)O3 可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
【答案】(1)H2O2+2I-+2H+=I2+2H2O(1分)
(2)![]() (1分)(3)-643.28kJmol-1(1分)
(1分)(3)-643.28kJmol-1(1分)
①KOH(1分)②O3+2KI+H2O=2KOH+I2+O2(2分)
(4)①A(1分)②50%(1分)③O2+4H++4e-=2H2O(2分)
【解析】
试题分析:(1)酸性条件下H2O2氧化碘化钾生成碘单质和水,反应的离子方程式为H2O2+2I-+2H+==I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为:![]() 。
。
(3)反应①N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ mol-1、反应②H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1、反应③H2O(l)=H2O(g) △H=+44kJ mol-1,根据盖斯定律可知,①+②×2+③×2即得到N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)的 △H=-534 kJ·mol—1-98.64 kJ·mol—1×+44 kJ·mol—1×2=-643.28kJ·mol—1。
(3)①该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物;②碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为O3+2KI+H2O=2KOH+I2+O2 ;
(4)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,A为阴极,电极反应为2H++2e-═H2↑,答案为A;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol,令臭氧的体积为xL,根据电子转移守恒有0.5×2=x×3×2+(0.2-x)×2×2,解得x=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为0.1mol÷0.2mol×100%=50%.
③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】为了测定某氯酸钾与二氧化锰混合物中氯酸钾的质量分数,课外小组的同学设计了如下实验:取3.0g 混合样品放入如图所示的大试管中,充分加热,直到反应完全,并用如图所示装置测量出生成氧气的体积。试回答下列问题:
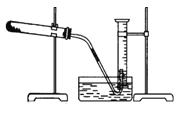
(1)如何检查装置的气密性?
(1)现有如下可供选择的操作:①将导气管放入盛满水的量筒内;②给药品加热;③有连续气泡产生时开始收集气体;④取出导气管;⑤反应完全后停止加热(如图,此时导管出口略高于液面);⑥冷却至室温;⑦调整量筒内外液面高度使之相同后读出量筒内气体体积数。
为了较准确地测量出生成的氧气在常温、常压下的体积,正确的操作顺序是(填序号)______________。
(3)为了较准确地测量到气体的体积,需要调整量筒内外液面高度,其原理是:____________________。
(4)在常温常压下共收集到气体680mL(此时氧气密度为1.41g·L-1),其质量为_______g,原混合物中氯酸钾的质量分数约是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是 ,违反了洪特规则的是 .
A. |
B. |
C. |
D. |
E.![]()
F.![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 .
(3)用符号“>”“<”或“=”表示下列各项关系.
①第一电离能:Na Mg,Mg Ca.
②电负性:O F,F Cl.
③能量高低:ns (n+1)s,ns np.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于
A. 氧化物 B. 酸 C. 碱 D. 盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )

A. 阳极产物一定是Cl2,阴极产物一定是Cu
B. BC段表示在阴极上是H+放电产生了H2
C. AB、BC段阴极反应都为Cu2+ + 2e-= Cu
D. CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体和MgCl2溶液共同具备的性质是
A. 均有丁达尔效应 B. 均能透过半透膜
C. 加入盐酸均先有沉淀,随后溶解 D. 均能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1、2)是有关氨的制取和性质的实验装置.

(1)仪器C的名称是 ;
(2)写出A中所发生化学反应的化学方程式 ;
(3)收集氨时,试管口棉花的作用 ;
(4)收集氨时,试管B验满的方法是 ;
(5)图1装置还可以制备 气体;
(6)图2装置进行喷泉实验,上部C充满氨气,引发水上喷的操作是 ;所得溶液呈 性(填酸性、碱性或中性),解释原因(用化学方程式表示) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com