
【题目】已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
下列结论正确的是( )
A.碳的燃烧热为ΔH=-221kJ/mol
B.1molC(s)和0.5molO2(g)所具有的能量高于1molCO(g)所具有的能量
C.稀硫酸与稀NaOH溶液反应放出的热量为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量大于57.3kJ
【答案】B
【解析】
A、碳的燃烧热是指1mol碳完全燃烧生成的稳定的氧化物CO2放出的热量,从2C(s)+O2(g)=2CO(g) ΔH=-221kJ/mol 可知1mol碳不完全燃烧生成CO放出110.5kJ,由题干数据无法计算碳的燃烧热,故A错误;
B、由反应①可知:C(s)+ ![]() O2(g)=CO(g) ΔH=-110.5kJ/mol,该反应放热,即1molC(s)和0.5molO2(g)所具有的能量高于1molCO(g)所具有的能量,故B正确;
O2(g)=CO(g) ΔH=-110.5kJ/mol,该反应放热,即1molC(s)和0.5molO2(g)所具有的能量高于1molCO(g)所具有的能量,故B正确;
C、未告知酸与碱的量,无法确定其酸碱中和放出的热量,故C错误;
D、醋酸为弱酸,其电离过程需要吸收能量,因此稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ,故D错误。


科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.60 |
回答下列问题:
(1)实验中,需要润洗的仪器是:________________________(填写仪器名称)。
(2)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是______________
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则消耗盐酸溶液的体积为________mL。
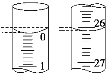
(4)下列操作中会使所测结果偏高的是_________________、偏低的是_________________
①酸式滴定管漏液;②滴定前酸式滴定管尖嘴部分有气泡,滴定过程中气泡变小;③滴定过程中,振荡锥形瓶时,不小心将溶液溅出;④滴定过程中,锥形瓶内加少量蒸馏水; ⑤用甲基橙作指示剂进行滴定时,溶液由橙色变红色时停止滴定;⑥用甲基橙作指示剂,溶液由黄色变橙色,5 s后又变为黄色。⑦读酸式滴定管读数时,滴定前仰视读数
(5)未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示物质是一种重要的化工原料。下列有关该有机化合物的叙述正确的是( )
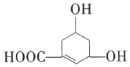
A.该有机化合物的分子式为![]() B.能使溴的
B.能使溴的![]() 溶液、酸性
溶液、酸性![]() 溶液褪色
溶液褪色
C.能发生酯化反应和水解反应D.具有相同种类和数量的官能团的结构共有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G在生活中有很多用途,工业上利用有机物A(![]() )来制备,其合成路线如图:
)来制备,其合成路线如图: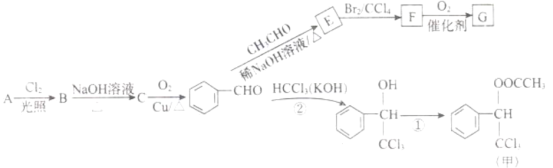
已知:![]()
![]()
![]()
![]() 、
、![]() 代表烃基或氢原子
代表烃基或氢原子![]()
回答下列问题:
(1)C的名称是______,F中官能团的名称是______。
(2)②的反应类型是______,E的结构简式为______。
(3)下列关于E的叙述正确的是______。
A.分子式为![]()
B. 1mol最多能与![]() 发生加成反应
发生加成反应
C. 自身能发生加聚、缩聚反应
D. 最多有9个碳原子位于同一平面
(4)C有多种同分异构体,其中属于芳香族化合物的有______种。
(5)写出反应①的化学方程式______。
(6)F的同分异构体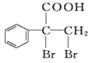 是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线
是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线![]() 其他所需原料自选
其他所需原料自选![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,医学上曾用类似G与新制氢氧化铜悬浊液的反应检验糖尿病;E是一种具有香味的物质,各物质间的转化如下图所示![]() 部分反应条件和产物已略去
部分反应条件和产物已略去![]() 。
。
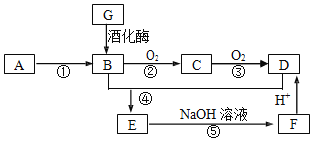
请回答下列问题:
(1)![]() 的结构简式为______
的结构简式为______
(2)写出下列反应的反应类型:![]() ______,
______,![]() ______
______
(3)写出E生成F的反应的离子方程式______
(4)下列说法正确的是______
A. 有机物B、C和D都可以与金属钠反应
B. 用新制的氢氧化铜悬浊液可以鉴别B、C、D
C. E的同分异构体中与E具有相同官能团的有三种(不包括E)
D. G是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线如下
,用石油裂解气合成M的路线如下
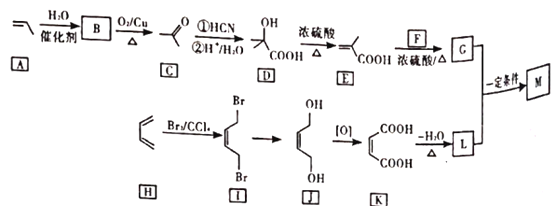
回答下列问题:
(1)B的化学名称为___________。
(2)F的分子式为___________。
(3)G中官能团的名称是___________,G与L在一定条件下生成M的反应类型是___________。
(4)I→J的反应方程式为___________。
(5)写出C的同分异构体的结构简式(核磁共振氢谱为三组峰,峰面积比为3︰2︰1)______。
(6)设计由苯乙烯为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物![]() 的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。
的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。
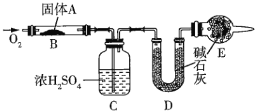
取![]() 放入装置中,通入过量
放入装置中,通入过量![]() 燃烧,生成
燃烧,生成![]() 和
和![]() ,请回答下列有关问题:
,请回答下列有关问题:
(1)通入过量![]() 的目的是_________。
的目的是_________。
(2)![]() 装置的作用是________________,
装置的作用是________________,![]() 装置的作用是___________。
装置的作用是___________。
(3)通过该实验能否确定![]() 中是否含有氧原子________(填“能”或“不能”)。
中是否含有氧原子________(填“能”或“不能”)。
(4)若![]() 的摩尔质量为
的摩尔质量为![]() ,
,![]() 装置增重
装置增重![]() ,
,![]() 装置增重
装置增重![]() ,则
,则![]() 的分子式为________。
的分子式为________。
(5)写出![]() 燃烧的化学方程式:________________。
燃烧的化学方程式:________________。
(6)![]() 可发生水解反应,
可发生水解反应,![]() 可水解生成2种互为同分异构体的产物,且这两种产物均为
可水解生成2种互为同分异构体的产物,且这两种产物均为![]() ,则
,则![]() 在催化剂作用下水解的化学方程式为_____。
在催化剂作用下水解的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com