
【题目】下列实验操作、现象以及结论完全对应的是
实验操作 | 实验现象 | 结论 | |
A | 0.1 mol/L MgSO4溶液中滴加过量NaOH 溶液,再滴加 0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后变为浅蓝色沉淀 | Cu(OH)2溶度积比Mg(OH)2小 |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向酸性KMnO4溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
D | 向FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A. AB. BC. CD. D
【答案】C
【解析】
A. 氢氧化钠过量;
B. 铁与水不反应;
C. 乙醇可与酸性高锰酸钾发生氧化还原反应;
D. 二氧化硫被氧化成硫酸,生成的沉淀为硫酸钡;
A. 0.1 mol/L MgSO4溶液中滴加过量NaOH溶液,因生成氢氧化镁,所以有白色沉淀生成,再滴加0.1 mol/L CuSO4溶液有浅蓝色沉淀,是因为铜离子与过量的NaOH溶液反应生成氢氧化铜所致,并不是沉淀的转化,所以结论不正确,A项错误;
B. 铁粉与水不反应,但铁粉与水蒸气在高温条件下会反应,其化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4为黑色,所以实验现象与结论均错误,故B项错误;
Fe3O4+4H2,Fe3O4为黑色,所以实验现象与结论均错误,故B项错误;
C. 向酸性KMnO4溶液中滴加乙醇,乙醇被酸性高锰酸钾氧化,使溶液褪色,说明乙醇具有还原性,故C项正确;
D. FeCl3和BaCl2混合溶液中通入足量SO2,铁离子与二氧化硫发生氧化还原反应,Fe3+被还原为Fe2+,同时生成BaSO4,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B 形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图:________。
(2)写出元素D在元素周期表中的位置:第____周期,第____族;该元素形成的单质的结构式为______。
(3)写出下列物质的电子式:A、B、E形成的化合物______;D、E形成的化合物______。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服________。
(5)A、B两元素组成的化合物A2B2属于______(填“离子”或“共价”)化合物,其存在的化学键有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是

A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X的电子总数=周期序数=族序数,他们的单质或化合物存在如图所示的转化关系,其中甲、戊是两种最常见的金属单质,丁是非金属单质,其余为氧化物。下列说法正确的是

A. W的原子序数是Z的两倍,金属性强于Z
B. Z元素在周期表中的位置是第三周期Ⅲ族
C. 丙属于两性氧化物
D. 己的熔点高、硬度大,可用作耐火坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
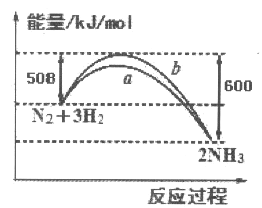
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是( )
A. 甲烷化学性质比较稳定,不被任何氧化剂氧化
B. 甲烷分子具有正四面体结构
C. 甲烷分子中具有极性键
D. 甲烷分子中四个C﹣H键是完全相同的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是

A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 在0≤pH≤5时,HMnO4溶液满足![]()
C. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂________,离子方程式___________。
(2)CO2(HCl):试剂________,离子方程式__________。
(3)![]() (CO
(CO![]() )试剂______________________,离子方程式______
)试剂______________________,离子方程式______
(4)C粉(Fe2O3):试剂____,离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)![]() Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A. 该反应的化学方程式是2HF![]() (HF)2
(HF)2
B. 平衡时混合气体的平均摩尔质量是33.3
C. t1时刻,保持温度不变,再充入1molM,重新达到平衡时,![]() 将增大
将增大
D. M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com