
【题目】下列每组中各有三对混合物,它们都能用分液漏斗分离的是( )
A. 煤油和水,酒精和水,醋酸和水B. 植物油和水,四氯化碳和水,苯和水
C. 酒精和水,汽油和水,汽油和酒精D. 苯和水,四氯化碳和苯,醋酸和水
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示.下列说法中正确的是( ) 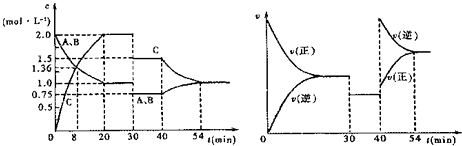
A.反应方程式中的x=1
B.该反应为放热反应
C.30 min时改变的条件是加入催化剂
D.前30 min内A的反应速率为0.05 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R分子的质量为a g,相对质量为M,则M与a的比值等于( )
A.6.02×1023
B.12C原子质量的十二分之一
C.0.012Kg12C所含的原子数
D.1mol氧气所含的微粒数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下,一定能大量共存的是( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO ![]() 、NO
、NO ![]()
B.c(H+)=1×10﹣1mol?L﹣1的溶液中:Cu2+、A13+、SO ![]() 、NO
、NO ![]()
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH ![]() 、S2﹣、Br﹣
、S2﹣、Br﹣
D.水电离出的c(H+)为1×10﹣12 mol?L﹣1的溶液中:Na+、Mg2+、Cl﹣、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
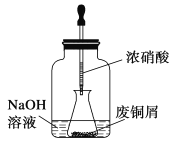
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________。
(2)上图装置中NaOH溶液的作用是_________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
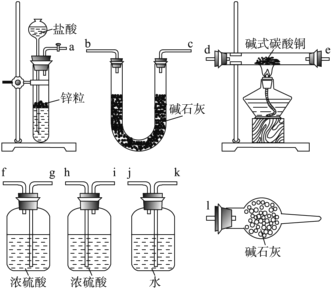
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式:__________________;
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________(填“可行”或“不可行”)请说明理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是( )
A.c(NH ![]() )>c(Cl﹣)>c(OH﹣)>c(H+)
)>c(Cl﹣)>c(OH﹣)>c(H+)
B.c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
C.c(Cl﹣)>c(NH ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
D.c(Cl﹣)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 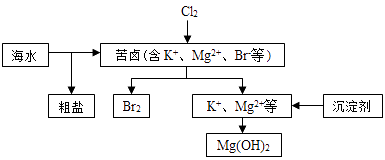
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:已知:①SO2(g)+Cl2(g)SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.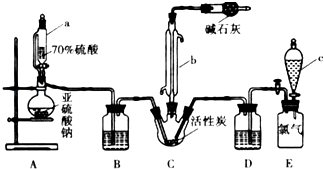
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .
(2)装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有
(3)反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式
(4)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com