
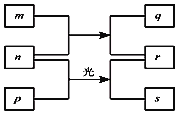
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小![]()
B.元素的非金属性![]()
C.Y的氢化物常温常压下为气态
D.X的最高价氧化物对应的水化物为弱酸
【答案】D
【解析】
短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl,氯气与p在光照条件下生成r与s,0.01molL-1r溶液的pH为2,则r为HCl,p为CH4,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可知W为H元素,X为C元素,Y为O元素,结合元素周期律分析解答。
A.所有元素中H原子半径最小,同周期自左而右原子半径减小,故原子半径W(H)<Y(O)<X(C),故A错误;
B.氯的氧化物中氧元素表现负化合价,氧元素非金属性比氯的强,高氯酸为强酸,碳酸为弱酸,氯元素非金属性比碳的强,故非金属性Y(O)>Z(Cl)>X(C),故B错误;
C.氧元素氢化物为水,常温下为液态,故C错误;
D.X的最高价氧化物的水化物为碳酸,碳酸属于弱酸,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJ·min-1
2HI(g) △H=-9.48kJ·min-1
②I2(s)+H2(g)![]() 2HI(g) △H=+26.48kJ·min-1
2HI(g) △H=+26.48kJ·min-1
下列说法正确的是
A.该条件下,l mol H2(g)和l mol I2(g)充分反应,放出热量9.48kJ
B.该条件下,碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1
C.相同条件下,Cl2(g)+H2(g)=2HCl(g)的△H >-9.48 kJ·min-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:
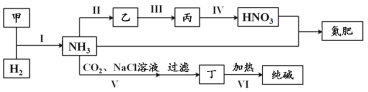
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板.上的铜膜,某教师为了从腐蚀废液(含有大量FeCl3、FeCl2、CuCl2)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用。准备采用下列步骤:
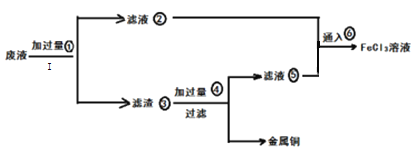
(1)步骤I的操作名称:_________________ :所需玻璃仪器:_______________________
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:__________________________________
(3)检验废腐蚀液中是否含有Fe3+所需试剂:______________________(填名称)
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________此转化的化学方程式为:___________________________________________________________
(5)写出③中所含物质:__________________(填化学式)⑥发生反应的离子方程式:________
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_____(填写编号)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是( )

物质 选项 | 甲 | 乙 | 丙 | 戊 | 丁 |
A | Cu | HNO3 | Cu(NO3)2 | Fe | NO |
B | H2O | Fe | H2 | O2 | Fe2O3 |
C | Al | NaOH | H2 | Al2O3 | NaAlO2 |
D | CH3CHO | O2 | CH3COOH | H2 | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列典型物质的电离方程式
(1)H2SO4_________________________________________
(2)Fe(OH)3________________________________________
(3)NaHSO4_________________________________________
(4)NaHCO3________________________________________
(5)Al2O3(熔融)____________________________________
II.写出下列典型反应的离子方程式:
(1)在稀H2SO4中加入CH3COONa溶液___________________________________
(2)氧化镁溶于稀硫酸______________________________________________
(3)CuSO4溶液与Ba(OH)2溶液混合_______________________________________
(4)NaHCO3溶液与稀盐酸混合________________________________________
(5)NaHSO4溶液与NaOH溶液混合_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要合氯消毒剂和漂白剂亚氯酸钠(NaClO2),工艺流程如下:
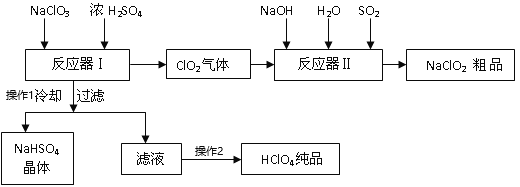
已知:a. NaHSO4的溶解度随着温度的升高而增大,适当条件下可结晶析出;
b.高氯酸是至今为止人们已知酸中的最强酸,沸点:90℃。
(1)操作①冷却过滤的目的是__________________
(2)反应器I中发生化学反应的方程式是_________________,反应器I中的温度最佳为__________(填序号);操作②的名称为______________。
A.0℃ B. 20℃ C. 80℃ D. 120℃
(3)反应器II中发生反应的离子方程式为_________;SO2的作用为_______________(氧化剂、还原剂)。
(4)加快反应器II中反应速率的措施有___________(写出2种措施即可)等。从反应器II中获得NaClO2粗品的实验操作依次是______________(选序号,下同),进一步提纯的操作名称为______________
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com