
【题目】碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJ·min-1
2HI(g) △H=-9.48kJ·min-1
②I2(s)+H2(g)![]() 2HI(g) △H=+26.48kJ·min-1
2HI(g) △H=+26.48kJ·min-1
下列说法正确的是
A.该条件下,l mol H2(g)和l mol I2(g)充分反应,放出热量9.48kJ
B.该条件下,碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1
C.相同条件下,Cl2(g)+H2(g)=2HCl(g)的△H >-9.48 kJ·min-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。已知:K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,在0~5 ℃的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与Fe(NO3)3反应制备K2FeO4(夹持装置略去)。回答下列问题:
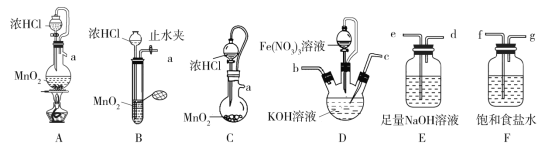
(1)盛放Fe(NO3)3溶液的仪器名称为______________________。
(2)氯气的发生装置可以选择图中的________(用图中大写字母表示);检查装置B气密性的操作为___________。
(3)选择上述装置,制备K2FeO4,按气流从左到右的方向,合理的连接顺序a→______(填仪器接口字母,仪器不可重复使用)。
(4)装置D中生成K2FeO4的离子方程式为__________;实验过程中若装置D的液面上方出现黄绿色气体后,再滴加Fe(NO3)3溶液会产生大量红褐色沉淀,用必要的文字和离子方程式分析原因:_______________
(5)制备的高铁酸钾粗产品中含有KNO3、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品,溶于_____________;
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用____________洗涤2~3次,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
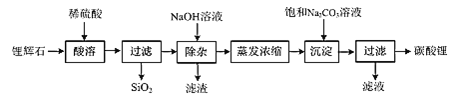
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定一定浓度邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如右图所示,其中b点为反应终点。下列叙述错误的是:
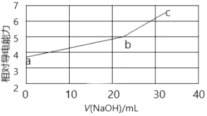
A.混合溶液的导电能力与溶液中离子的浓度、种类有关
B.b点的混合溶液pH<7
C.邻苯二甲酸氢钾溶液的pH<7
D.c点的混合溶液中,c(Na+) > c(K+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是( )
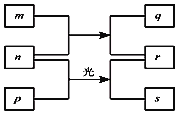
A.原子半径的大小![]()
B.元素的非金属性![]()
C.Y的氢化物常温常压下为气态
D.X的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com