
【题目】NaOH溶液滴定一定浓度邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如右图所示,其中b点为反应终点。下列叙述错误的是:
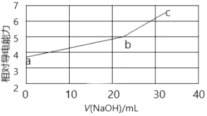
A.混合溶液的导电能力与溶液中离子的浓度、种类有关
B.b点的混合溶液pH<7
C.邻苯二甲酸氢钾溶液的pH<7
D.c点的混合溶液中,c(Na+) > c(K+)>c(OH-)
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁[主要含MgCO3和Mg(OH)2]是制取氧化镁的工业原料。某研究性学习小组用如图所示装置确定轻质碳酸镁的组成。向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后测得D装置增重0.88 g;向B所得溶液中加入足量NaOH溶液,过滤,将所得沉淀洗涤、低温干燥、称量所得Mg(OH)2固体为1.45 g。
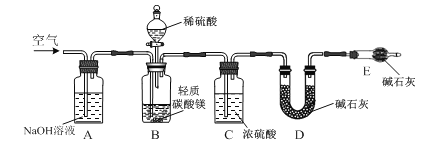
⑴ 反应后需向装置A中缓缓鼓入空气,目的是________。
⑵ 某同学旋转分液漏斗下面的活塞,发现液体不能顺利流下,可能的原因是________。
⑶ 由浓硫酸配制100mL 1.00 mol·L-1的硫酸,下列操作会使所配溶液浓度偏低的是________填字母)。
A.容量瓶使用前未干燥,有少量水残留
B.定容时,俯视容量瓶刻度线
C.加水时超过刻度线,用胶头滴管吸出多余的液体
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶
⑷ 该轻质碳酸镁中MgCO3和Mg(OH)2物质的量的比值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJ·min-1
2HI(g) △H=-9.48kJ·min-1
②I2(s)+H2(g)![]() 2HI(g) △H=+26.48kJ·min-1
2HI(g) △H=+26.48kJ·min-1
下列说法正确的是
A.该条件下,l mol H2(g)和l mol I2(g)充分反应,放出热量9.48kJ
B.该条件下,碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1
C.相同条件下,Cl2(g)+H2(g)=2HCl(g)的△H >-9.48 kJ·min-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从茶叶中提取的茶多酚具有抗氧化、清除自由基,预防心血管疾病等多方面药理功能,是一种新型的无毒天然食品添加剂。茶多酚为淡黄至茶褐色粉状固体,其涩味,易溶于水、乙醇、乙酸乙酯,微溶于油脂,并能与某些金属离子反应形成沉淀。科研工作者提取茶多酚的一种工艺如下:
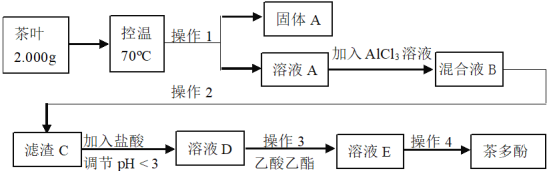
已知:
①收率指投入单位数量原料获得的实际产品产量与理论计算产品产量的比值。
②0.159g高锰酸钾能与2.91mg茶多酚反应完全。
请回答:
(1)下列说法正确的是:_____________。
A 将茶叶样品粉碎、控制温度均是为了加快速率,提高茶多酚的浸出率
B 操作1和2都是过滤,均需对滤渣进行洗涤且合并洗涤液
C 加入较高浓度的盐酸,会造成茶多酚的收率降低
D 操作4为真空干燥,其原理与蒸馏相似
(2)热水浸泡时间过长,温度过高均造成茶多酚的收率降低,原因是______。
(3)操作3为萃取分液,其实验过程如下,合理的操作步骤为___________。
①将分液漏斗放置于铁架台上,静置
②从上口倒出乙酸乙酯层
③将溶液D和乙酸乙酯分别加入到分液漏斗中
④检查分液漏斗是否漏水
⑤充分振荡并放气
⑥从下口放出下层溶液
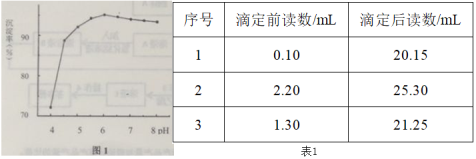
(4)研究发现,用AlCl3+ZnCl2的复合沉淀剂效果更理想。向溶液A中加入复合沉淀剂,常温下进行茶多酚沉淀,用0.1 mol·L-1的Na2CO3溶液调节pH。其他条件相同,不同pH时,测得茶多酚的沉淀率如图1,请结合图1,解释选择pH=6进行茶多酚沉淀的可能原因________。
(5)将溶液A定容至50 mL,每次取10.0 mL,用0.159 g·mL-1的高锰酸钾进行滴定,数据如下表1,则该次实验,测得茶叶中茶多酚的含量为_______mg·g-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量Fe2O3和Al2O3的混合固体溶解在200mL 0.1mol·L-1的过量H2SO4溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A. 0.4 mol·L-1 B. 0.2 mol·L-1
C. 0.1 mol·L-1 D. 0.8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是( )

物质 选项 | 甲 | 乙 | 丙 | 戊 | 丁 |
A | Cu | HNO3 | Cu(NO3)2 | Fe | NO |
B | H2O | Fe | H2 | O2 | Fe2O3 |
C | Al | NaOH | H2 | Al2O3 | NaAlO2 |
D | CH3CHO | O2 | CH3COOH | H2 | H2O |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com