
����Ŀ����1�������£���1mLpH=1��H2SO4��Һ��ˮϡ�͵�100ml��ϡ�ͺ����Һ��![]() =______��
=______��
��2��ij�¶�ʱ�����0.01mol/L��NaOH��Һ��pHΪ11������¶���ˮ�����ӻ�����KW=____�����¶�______(��������������������)25�档
��3������2�������¶��£���pH=a��NaOH��ҺVaL��pH=b������Vb L�����
�������û��ҺΪ���ԣ���a =12��b=2����Va ��Vb=____________��
�������û����Һ��pH=l0����a=12��b=2����Va ��Vb=____________��
��4�������£���pH=5��H2SO4��Һ����ˮ�������H+Ũ��Ϊc1��pH=5��Al2(SO4)3��Һ����ˮ�������H+Ũ��Ϊc2����![]() =________��
=________��
���𰸡� 10-8 10-13 ���� 1��10 1��9 10-4
��������(1)pH=1��������c(H+)=0.1 mol��L-1��ϡ��100����c(H+)=10-3 mol��L-1����c(OH-)=10-11 mol��L-1����![]() =
=![]() =10-8����2��0.01mol/L��NaOH��Һ��pHΪ11����c��H+��=1��10-11mol/L��c��OH-��=0.01mol/L��Kw=c��H+����c��OH-��=1��10-13����2��ˮ�ĵ������ȣ������¶ȣ�����̶���������ˮ�����ӻ�Ϊ10-14�����¶���ˮ�����ӻ��ȳ����µĴ��¶ȸ���25������3����pH=a��NaOH��ҺVa L��pH=b������Vb L��ϣ��������û����ҺΪ���ԣ���a=12��b=2����c��OH-����Va=c��H+����Vb��a=12��b=2����0.1��Va=0.01Vb����Va��Vb=1��10���������û����Һ��pH=10���������c��OH-��=
=10-8����2��0.01mol/L��NaOH��Һ��pHΪ11����c��H+��=1��10-11mol/L��c��OH-��=0.01mol/L��Kw=c��H+����c��OH-��=1��10-13����2��ˮ�ĵ������ȣ������¶ȣ�����̶���������ˮ�����ӻ�Ϊ10-14�����¶���ˮ�����ӻ��ȳ����µĴ��¶ȸ���25������3����pH=a��NaOH��ҺVa L��pH=b������Vb L��ϣ��������û����ҺΪ���ԣ���a=12��b=2����c��OH-����Va=c��H+����Vb��a=12��b=2����0.1��Va=0.01Vb����Va��Vb=1��10���������û����Һ��pH=10���������c��OH-��=![]() =0.001����Va��Vb=1��9����4��������Һ�е����������ӡ���������Һ�е���������ˮ����ģ�pH=5��������Һ����ˮ�������H+Ũ��Ϊc1=
=0.001����Va��Vb=1��9����4��������Һ�е����������ӡ���������Һ�е���������ˮ����ģ�pH=5��������Һ����ˮ�������H+Ũ��Ϊc1=![]() =10-9mol/L��pH=5��Al2(SO4)3��Һ����ˮ�������H+Ũ��Ϊc2=10-5mol/L����
=10-9mol/L��pH=5��Al2(SO4)3��Һ����ˮ�������H+Ũ��Ϊc2=10-5mol/L����![]() =
=![]() =10-4��
=10-4��


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A. SO2��SO3���Ǽ��Է���
B. ���ȶ��ԣ�HF>H2O>NH3
C. һ��N2��������һ��������2������
D. NH4+Ϊ��������ṹ�����Ʋ�PH4+ҲΪ��������ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯīΪ�缫�����KI��Һ�����к���������̪�͵��ۣ�������˵��������ǣ� ��
A. ����������Һ�ʺ�ɫ B. �����ݳ�����
C. ����������Һ����ɫ D. ��Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���������ʵ��װ�ý���NH3�Ĵ�����ʵ�顣
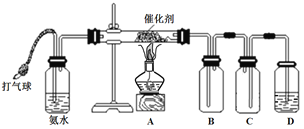
����д���пհף�
��1����ʵ�����õİ�ˮ����������Ϊ15%���ܶ�Ϊ0.94gmL-1����ð�ˮ�����ʵ���Ũ��Ϊ___________��ʵ�������Ƹ����ʵ���Ũ�Ȱ�ˮ�Ĺ����в�������������_____________ ��
��2�����Ӻ�װ�ú���D��װ������ˮ��û���ܿڣ�������װ���й����������ʾװ�����������õ�������________________________________��
��3��ʵ�����һ��ʱ���B�г��ֺ���ɫ����ȥ�ƾ��ƣ������������ֺ��ȡ�
�ٴ������ֺ��ȵ�ԭ����______________________________________��
�ڰ��������Ļ�ѧ����ʽΪ____________________________________��
��4���ӿ�����ٶ�ʱ��B�л���ְ��̡����̵ijɷ���_________���ѧʽ��
��5��Ϊ��ô�����NO2������װ��A��B֮������____________��
a.ʢ�м�ʯ�ҵĸ���� b.ʢ��Ũ�����ϴ��ƿ c.ʢ����ˮCaCl2��ϴ��ƿ
��6����ʵ��˵������������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽ���ܱ�ʾ���ʵ���ɣ����ܱ�ʾ���ʷ���ʽ����
A.NaB.SiO2C.H2OD.CuSO4��5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.001mol/L�����Ը��������Һ�ζ�δ֪Ũ�ȵIJ���(H2C2O4)��Һ���ش����� ���⣺
��1�����Ը��������ҺӦ��װ����ͼ__________�ζ�������
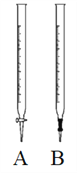
��2����д���÷�Ӧ�����ӷ���ʽ��____________________��
��3����0.001mol/L�����Ը��������Һ�ζ�������Һ���ζ��յ���ж������ǣ�_________________��
��4����֪�ζ�V1ml����Һ���ı�Һʵ���������±�
ʵ����� | ʼ����(ml) | ĩ����(ml) | ������� |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
�����Һ��Ũ��Ϊ��_______________
��5���ζ�����ʱ�����ӿ̶��߶�ȡ���������Һ��������ᵼ�²ⶨ���_________(����ƫ������ƫС��������Ӱ����)
��6����֪NaHC2O4��Һ�в���������ӵĵ������ˮ�⣬����Һ�и����ӵ�Ũ�Ȱ��ɴ�С��˳�����е��ǣ�_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. 1molN2Լ����6.02��1023����ԭ��
B. 1mol H2O�к���2mol��ԭ�Ӻ�1mol��ԭ��
C. �Ƶ�Ħ�����������������ԭ������
D. �����Ħ����������98g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.ʳƷ���г�����ʯ�ң�����������������
B.NaHCO3����������ɷ��������������Ż�������������
C.��������ڻ��ʡ�ҽҩ��ũҩ��������������ʯ�Ĵ���
D.���ڵ�����ҵ�Ĵ�ͭ���ɻ�����ұ��ֱ�ӵõ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У��������㡰 ![]() ��ת����ϵ��һ���ǣ� ��
��ת����ϵ��һ���ǣ� ��
X | Y | Z | |
A | Si | SiO2 | Na2SiO3 |
B | HNO3 | NO | NO2 |
C | Al2O3 | NaAlO2 | Al��OH��3 |
D | Cu | CuO | CuSO4 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com