
【题目】某学习小组设计如下实验装置进行NH3的催化氧化实验。
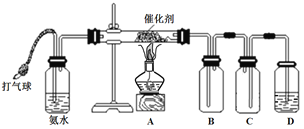
请填写下列空白:
(1)该实验所用的氨水的质量分数为15%,密度为0.94gmL-1,则该氨水的物质的量浓度为___________。实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有_____________ 。
(2)连接好装置后,在D中装入少量水浸没导管口,轻轻向装置中鼓入空气。表示装置气密性良好的现象是________________________________。
(3)实验进行一段时间后,B中出现红棕色。移去酒精灯,催化剂继续保持红热。
①催化剂保持红热的原因是______________________________________。
②氨催化氧化的化学方程式为____________________________________。
(4)加快鼓气速度时,B中会出现白烟。白烟的成分是_________(填化学式)
(5)为获得纯净的NO2,可在装置A与B之间连接____________。
a.盛有碱石灰的干燥管 b.盛有浓硫酸的洗气瓶 c.盛有无水CaCl2的洗气瓶
(6)该实验说明氨的性质有__________________。
【答案】 8.3molL-1 搅拌、引流 D装置的导管口有气泡冒出 NH3催化氧化是放热反应 4NH3 + 5O2![]() 4NO + 6H2O NH4NO3或NH4NO2 b 还原性、碱性、易溶于水等
4NO + 6H2O NH4NO3或NH4NO2 b 还原性、碱性、易溶于水等
【解析】(1)该实验所用的氨水的质量分数为15%,密度为0.94gmL-1,则该氨水的物质的量浓度为c=![]() =
=![]() =8.3mol/L;实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有:稀释浓氨水时搅拌,转移氨水到容量瓶中时引流,故答案为:8.3molL-1;搅拌、引流;
=8.3mol/L;实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有:稀释浓氨水时搅拌,转移氨水到容量瓶中时引流,故答案为:8.3molL-1;搅拌、引流;
(2)连接好装置后,在D中装入少量水浸没导管口,轻轻向装置中鼓入空气,如果装置气密性良好,则在D装置的导管口有气泡冒出,故答案为:D装置的导管口有气泡冒出;
(3)①催化剂保持红热是因为该反应是放热反应,故答案为:NH3催化氧化是放热反应;
②氨催化氧化的化学方程式为4NH3 + 5O2![]() 4NO + 6H2O,故答案为:4NH3 + 5O2
4NO + 6H2O,故答案为:4NH3 + 5O2![]() 4NO + 6H2O;
4NO + 6H2O;
(4)反应过程中生成的一氧化氮被氧化生成二氧化氮,二氧化氮与水蒸气反应生成了硝酸气体,加快鼓气速度时,B中会出现白烟,是过量的氨气与硝酸气体反应生成的NH4NO3,故答案为:NH4NO3;
(5)a.盛有碱石灰的干燥管,会吸收二氧化氮,错误;b.盛有浓硫酸的洗气瓶,会除去未反应的氨气和水蒸气,可以得到纯净的NO2,正确;c.盛有无水CaCl2的洗气瓶可以吸收氨气,但生成物不稳定,受热容易分解,不能保证氨气被吸收干净,错误;故选b;
(6)该实验说明氨发生催化氧化,说明氨气具有还原性,通过向氨水中通入空气会吹出氨气,说明氨气易溶于水,加快鼓气速度时,B中会出现白烟,说明氨气具有碱性,故答案为:还原性、碱性、易溶于水等。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
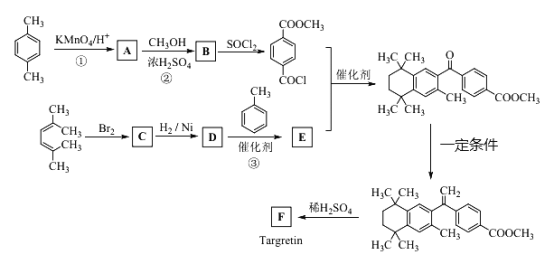
【题目】药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路饯如下图所示:
已知:①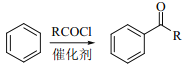
②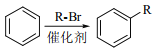
③![]() (R表示烃基或芳基)
(R表示烃基或芳基)
(1)反应①的反应类型是______________________
(2)反应②的化学方程式_________________________________________。
(3)C的结构简式是_____________________________________________。
(4)反应③的化学方程式____________________________________________。
(5)F的分子式C24H28O2,F中含有的官能团____________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构)________________________________。
结构)________________________________。
a.苯环上的一氯代物有两种 b.既发生银镜反应又能发生水解反应
(7)已知: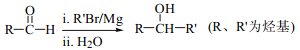 ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为( )
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K 是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
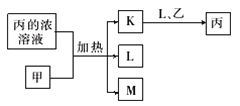
A. K、L、M 中沸点最高的是M
B. 元素的非金属性:Z>Y>X
C. 原子半径:W<X<Y
D. 丙也可由W、Y组成的某化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100ml,稀释后的溶液中![]() =______。
=______。
(2)某温度时,测得0.01mol/L的NaOH溶液的pH为11,则该温度下水的离子积常数KW=____,该温度______(填“高于”或“低于”)25℃。
(3)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a =12,b=2,则Va :Vb=____________。
②若所得混合溶液的pH=l0,且a=12,b=2,则Va :Vb=____________。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5是Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =________。
=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的叙述中正确的是
A.在共价化合物分子中一定同时存在σ键和π键
B.离子化合物的熔点一定比共价化合物的高
C.全由非金属元素组成的化合物一定是共价化合物
D.含有阳离子的化合物一定含有阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com