
【题目】如图所示装置,室温下密闭容器内分别充入空气和H2.O2的混合气体在可移动的活塞两边,在标准状况下若将H2.O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2.O2的体积比最接近于 ( )

①2:7 ②5:4 ③4:5 ④7:2
A.①②B.②④C.③④D.①③
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3溶液可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)![]() Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
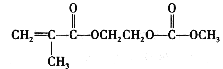
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是____________________________________。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有________、________、________(填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为____________________________________。
(4)写出M与足量氢氧化钠溶液反应的化学方程式:____________________________________。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
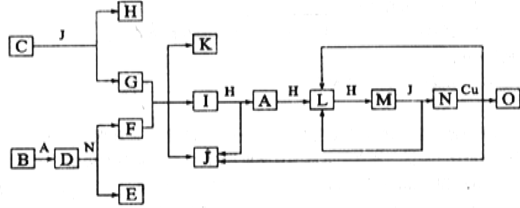
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的熔沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应![]() (方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
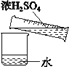
A.下列各项(①温度;②浓度;③容量;④刻度;⑤刻度线),其中容量瓶上标有①③④
B.用18.4 mol/L的硫酸配制1 mol/L稀硫酸的实验有如图所示的操作
C.容量瓶用蒸馏水洗净后要烘干以除去残留的水
D.若用含有Na2O的NaOH配制溶液,则所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1mol O2在该条件下的体积也为30L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:

已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com