
【题目】(1)补充完成下表:(请把序号①一④的答案对应填入答题卡上) _________
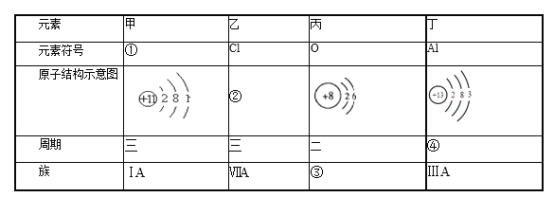
(2)甲元素最高价氧化物对应的水化物呈_________性(填“酸、碱”),乙元素最高价氧化物对应的水化物的化学式为_________________
(3)甲与乙两元素的单质反应生成物的电子式为___________________
(4)比较这四种元素的原子半径大小:_____ > _____ >_____ >______ (填元素符号)
(5)甲单质与丙的氢化物反应的离子方程式为_________________________________
(6)甲元素最高价氧化物对应水化物与丁元素最高价氧化物反应的化学方程式为__________
【答案】Na、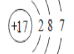 、ⅥA、三 碱
、ⅥA、三 碱 ![]()
![]() Na Al Cl O; 2Na+2H2O=2Na++2OH-+H2↑ Al(OH)3+NaOH═NaAlO2+2H2O
Na Al Cl O; 2Na+2H2O=2Na++2OH-+H2↑ Al(OH)3+NaOH═NaAlO2+2H2O
【解析】
(1)甲原子结构示意图是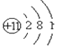 ,质子数为11,是钠元素;乙是氯元素。质子数是17,最外层有7个电子;丙是氧元素,最外层电子数是6;丁是铝元素,有3个电子层;
,质子数为11,是钠元素;乙是氯元素。质子数是17,最外层有7个电子;丙是氧元素,最外层电子数是6;丁是铝元素,有3个电子层;
(2)甲元素最高价氧化物对应的水化物是氢氧化钠;氯元素最高价氧化物对应的水化物是高氯酸;
(3)钠与氯气反应的生成物是氯化钠;
(4)电子层数越多半径越大,电子层数相同时,质子数越多半径越小;
(5)钠与水反应生成氢氧化钠和氢气;
(6)氢氧化铝是两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(1)甲原子结构示意图是 ,质子数为11,甲是Na元素;乙是氯元素,质子数是17,最外层有7个电子,氯的原子结构示意图是
,质子数为11,甲是Na元素;乙是氯元素,质子数是17,最外层有7个电子,氯的原子结构示意图是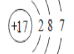 ;丙是氧元素,最外层电子数是6,位于周期表第二周期、第ⅥA族;丁是铝元素,有3个电子层,位于周期表第三周期、第ⅢA族;
;丙是氧元素,最外层电子数是6,位于周期表第二周期、第ⅥA族;丁是铝元素,有3个电子层,位于周期表第三周期、第ⅢA族;
(2)甲是钠元素,钠的最高价氧化物对应的水化物是氢氧化钠,水溶液呈碱性;乙是氯元素,氯的最高价氧化物对应的水化物是高氯酸,化学式为![]() ;
;
(3)钠与氯气反应的生成物是氯化钠,氯化钠是离子化合物,电子式为![]() ;
;
(4)O原子电子层数最少,半径最小;Na、Al、Cl电子层数相同,质子数越多半径越小,原子半径大小:Na > Al >Cl>O
(5)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑
(6) 氢氧化铝是两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置(省略夹持装置及加热装置)可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是 ( )
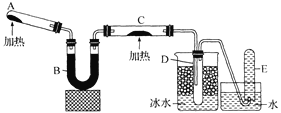
A.试管A中加入的试剂为NH4Cl固体
B.反应中氧化剂和还原剂的物质的量之比为2 : 3
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如图:
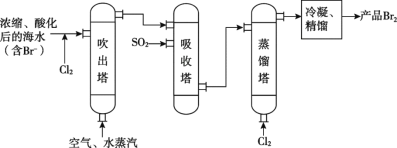
下列说法中,不正确的是( )
A.海水提溴发生的所有反应均为氧化还原反应
B.每提取1mol溴,理论上消耗氯气44.8升
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中还发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 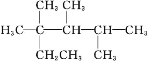 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
D.C6H14的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
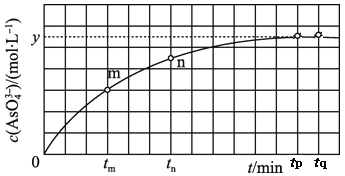
①下列可判断反应达到平衡的是__(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
e.![]() =
=![]() 不再变化
不再变化
②tn时,v正__v逆(填“大于”“小于”或“等于”)。
③tm时v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
④比较产物AsO![]() 在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是
A.CH≡C-CH=CH-CH3 中σ键和π键数目之比为 10:3
B.![]() 分子中不含手性碳原子
分子中不含手性碳原子
C.硫难溶于水,微溶于酒精,易溶于 CS2,说明极性:水>酒精>CS2
D.由 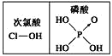 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com