
【题目】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分別充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____。
②T1___(填“>”或“<”)T2,该反应是_____(填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___(填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___(填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成 NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______(列出数学计算式)。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=799kJ·mol1 0.01mol/L·min > 放热 42.19 小 > c(Na+)>c(NO)>c(OH)>c(H+) 105109
【解析】
(1)CH4在常温常压下,甲烷完全燃烧的化学方程式为CH4+2O2=CO2+2H2O(l),①N2(g)+O2(g)=2NO(g),②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l),②+2×①,△H=(-1160kJ·mol-1+2×180.5kJ·mol-1)=-799kJ·mol-1,即CH4燃烧的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=799kJ·mol1;
答案是CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=799kJ·mol1;
(2)①甲容器中生成CO2浓度为0.05mol·L-1,则消耗NO的浓度为0.05mol·L-1,根据化学反应速率的数学表达式,v(NO)=![]() =0.01mol/(L·min);
=0.01mol/(L·min);
答案为0.01mol/(L·min);
②甲先达到平衡,说明甲的温度高于乙,即T1>T2;根据图像,随着温度升高,CO2浓度降低,即平衡向逆反应方向移动,推出该反应的正反应方向为放热反应;
答案是>;放热反应;
③ 2NO+2CO![]() N2+2CO2
N2+2CO2
起始(mol/L):0.10 0.10 0 0
变化: 0.06 0.06 0.03 0.06
平衡: 0.04 0.04 0.03 0.06 根据平衡常数的表达式,K=![]() ,代入数值得出:K=42.19;该反应为放热反应,温度越高,化学平衡常数越小,因此T1温度时的平衡常数小;
,代入数值得出:K=42.19;该反应为放热反应,温度越高,化学平衡常数越小,因此T1温度时的平衡常数小;
答案为42.19;小;
④在通入0.10molNO和0.1molCO2,此时NO的浓度为0.09mol·L-1,CO的浓度为0.04mol·L-1,N2浓度为0.03mol·L-1,CO2的浓度为0.11mol·L-1,浓度商Qc=![]() =
=![]() ≈28<42.19,反应向正反应方向移动,即v(正)>v(逆);
≈28<42.19,反应向正反应方向移动,即v(正)>v(逆);
答案是>;
(3)NaNO2为强碱弱酸盐,NO3-发生水解,溶液显碱性,因盐类水解程度微弱,因此离子浓度大小比较:c(Na+)>c(NO2-)>c(OH-)>c(H+);利用电荷守恒,c(Na+)+c(H+)=c(OH-)+c(NO2-),有c(Na+)-c(NO2-)=c(OH-)-c(H+)=(10 -5-10-9);
答案是:c(Na+)>c(NO2-)>c(OH-)>c(H+);(10 -5-10-9)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是
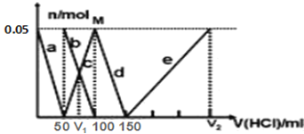
A. a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
B. M点时生成的CO2为0.05mol
C. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
D. V1∶V2=1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
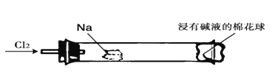
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是 ( )
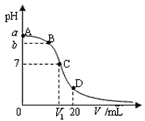
A. 当V=10mL时,溶液中存在: c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
B. A、C间任一点,溶液可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. 在C点,V1<10mL,且有 c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D. 在D点,存在:c(NH4+)+c(NH3·H2O)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、HCl、H2S、NH3均为气体。在标准状况下分别有①13.44 LCH4 ②1mol HCl分子 ③27.2 g H2S ④ 2.408×1023个NH3分子,下列说法正确的是( )
A.密度:②>③>①>④B.质量:②>③>④>①
C.H原子个数:①>③>④>②D.体积:②>③>④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。下列说法正确的是

A. 溶解度S(FeS)<S(ZnS)
B. a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-)
C. 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液
D. 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列有机物说法不正确的是( )
A. BrCH2CHBrCH2Br的名称为三溴丙烷
B. 萘环上的一个H原子被-C4H9取代后的产物共有8种
C. 对甲基苯乙烯中最多有17个原子共面
D. 纤维素和淀粉都是多糖,它们彻底水解后的产物相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com