
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是
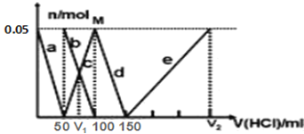
A. a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
B. M点时生成的CO2为0.05mol
C. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
D. V1∶V2=1∶4
【答案】D
【解析】
酸性强弱顺序为:![]() ,因此a曲线表示AlO2-的减少情况,发生的反应为
,因此a曲线表示AlO2-的减少情况,发生的反应为![]() ;b曲线表示
;b曲线表示![]() 逐渐减少的情况,发生的反应为
逐渐减少的情况,发生的反应为![]() ,同时c曲线表示
,同时c曲线表示![]() 逐渐增多;曲线d表示
逐渐增多;曲线d表示![]() 减少的情况,发生的反应为
减少的情况,发生的反应为![]() ;曲线e表示
;曲线e表示![]() 逐渐增多,发生的反应为
逐渐增多,发生的反应为![]() 。
。
A项,根据上述分析可知a曲线表示的离子方程式为:![]() ,故A项错误;
,故A项错误;
B项,c曲线表示![]() 逐渐增多,M点处全部转化为
逐渐增多,M点处全部转化为![]() ,并无
,并无![]() 气体产生,故B项错误;
气体产生,故B项错误;
C项,根据反应方程式![]() 、
、![]() ,且图中参与反应的浓度为
,且图中参与反应的浓度为![]() 的盐酸体积均为50mL,可知原混合溶液中的
的盐酸体积均为50mL,可知原混合溶液中的![]() 和
和![]() 的物质的量均为0.05mol,因此原混合溶液中的
的物质的量均为0.05mol,因此原混合溶液中的![]() 和
和![]() 的物质的量之比为1:1,故C项错误;
的物质的量之比为1:1,故C项错误;
D项,由b、c曲线关于y方向轴对称可知![]() ,根据反应
,根据反应![]() 和铝元素守恒可知,氢氧化铝消耗的盐酸的体积为150mL,所以
和铝元素守恒可知,氢氧化铝消耗的盐酸的体积为150mL,所以![]() ,所以
,所以![]() ,故D项正确;
,故D项正确;
综上所述,本题正确答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2NA
C. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04NA
D. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出方程式。
(1)铁和稀硫酸(写出离子方程式)___;
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)__;
(3)氧化铜和稀盐酸(写出离子方程式)__;
(4)制备氢氧化铁胶体(写出对应的化学方程式)___;
(5)CO32-+2H+=CO2↑+H2O(写出对应的化学方程式)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
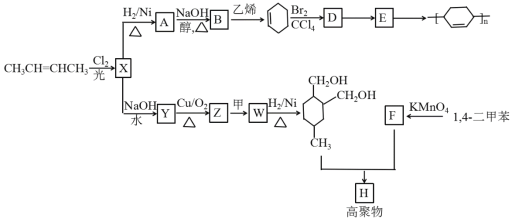
【题目】以烯烃为原料,合成某些高聚物的路线如下:
已知:Ⅰ.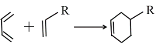 (R代表取代基或氢);
(R代表取代基或氢);
Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
(1)CH3CH=CHCH3的名称是_________,X中官能团的名称是______________。
(2)A→B的化学方程式是________________________________________。
(3)D→E的反应类型为:______。
(4)下列有关说法正确的是_________。
a.有机物Y与HOCH2CH2OH互为同系物
b.有机物Z能发生银镜反应
c.有机物Y的沸点比B低
d.有机物F能与己二胺缩聚成聚合物
(5)写出Z→W的化学方程式:____________________。
(6)Y的同分异构体中,含有酯基的有______种。
(7)高聚物H的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 向含0. 1 mol Na2SiO3的溶液中滴加盐酸,生成的H2SiO3胶体中胶粒的数目为0.1NA
B. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
C. 常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10 NA
D. 7.8gNa2O2分别与过量的CO2和过量的SO2充分反应,转移的电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)写出硫酸氢钠在水溶液中的电离方程式___;
(2)写出下列反应的离子方程式:
①氧化镁加入稀硫酸中___;
②氨水中加入稀盐酸___;
③FeCl3溶液中加入NaOH溶液:___。
(3)在标准状况下,4.48L的NH3气体物质的量为___mol,质量为___g,其中含___个氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。

(1)OA段、AB段发生反应的离子方程式为_________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有如下的转化关系(未配平): ① G → Q + NaCl ② Q + H2O →溶液X + H2 (电解时发生)③ Y + NaOH → G + Q + H2O ④ Z + NaOH → Q + X + H2O这五种化合物中氯的化合价由低到高的顺序为 ( )
A. ZXGYQB. GYZQXC. GYQZXD. QGZYX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分別充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____。
②T1___(填“>”或“<”)T2,该反应是_____(填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___(填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___(填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成 NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______(列出数学计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com