
����Ŀ��Cl2���仯�����������������о��й㷺����;��25��ʱ����������ˮ�γ���������ˮ��ϵ������ϵ��Cl2(aq)��HClO��ClO���ֱ�����������ռ������������pH�仯�Ĺ�ϵ��ͼһ��ʾ��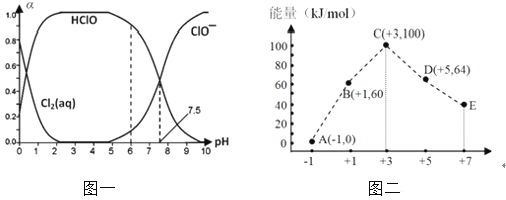
��1����֪HClO��ɱ��������ClO��ǿ����ͼһ��������������������ˮʱ��pH��7.5��pH��6ʱɱ��Ч��ǿ��������������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪ��
��2��ClO2��һ���ױ�ը��ǿ���������壬��һ�����õ���������������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡClO2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ���������ѧ�����о�������������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2�ķ������÷�Ӧ�����ӷ�Ӧ����ʽΪ���˷����ŵ�������ҵ�ϻ����õ�ⷨ�Ʊ�ClO2 �� ��80��ʱ����Ȼ�����Һ�õ�NaClO3 �� Ȼ�������ᷴӦ�õ�ClO2����������NaClO3����������������������ɣ�����ClO3�C�ĵ缫��ӦʽΪ��
��3��һ�������£���ˮ��Һ�� 1 mol Cl�C��1mol ClOx�C��x=1��2��3��4����������С��ϼ۵Ĺ�ϵ��ͼ����ʾ���������Ƕȿ���C��D��E����ȶ����������������ӷ��ţ���B �� A + D��Ӧ���Ȼ�ѧ����ʽΪ�������ӷ��ű�ʾ����
���𰸡�
��1��pH=6ʱ��Cl2(aq)��H2O ![]() HClO��H����Cl�� �� HClO
HClO��H����Cl�� �� HClO ![]() H����ClO�� �� Cl2(g)
H����ClO�� �� Cl2(g) ![]() Cl2(aq)
Cl2(aq)
��2��Cl2+2NaClO2 == 2NaCl+2ClO2��C2O42����2ClO3����4H��==2ClO2����2CO2����2H2O����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ�����Cl����6e��+3 H2O ��6H����ClO3��
��3��ClO2����3ClO��(aq) �� 2Cl��(aq)��ClO3��(aq) ��H��-116kJ/mol
���������⣺��1��HClO��ɱ��������ClO-ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ͼ֪��pH=6ʱHClO�����ϸߣ�����pH=6ʱƯ��Ч���Ϻã�
���ȵ����ʴ���ƽ���״̬Ϊ������ˮ��Ӧ�����������ƽ�⣬Һ̬��������̬������ƽ��ȣ�����-��ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪCl2��aq��+H2OHClO+H++Cl-�� HClOH++ClO- �� Cl2��g��Cl2��aq����
���Դ��ǣ�pH=6ʱ��Cl2��aq��+H2OHClO+H++Cl- �� HClOH++ClO- �� Cl2��g��Cl2��aq����
��2��ClO2��һ���µ�����������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡClO2 �� ���ԭ���غ�͵����غ�д���÷�Ӧ�Ļ�ѧ����Cl2+2NaClO2=2NaCl+2ClO2 ��
��������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2 �� ͬʱ���ɶ�����̼����Ӧ�����ӷ���ʽΪC2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O��
����Ȼ�����Һʱ��������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪCl--6e-+3 H2O=6H++ClO3- �� ��Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ�
���Դ��ǣ�Cl2+2NaClO2�T2NaCl+2ClO2��C2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ����� Cl--6e-+3H2O=6H++ClO3-��
��3��ͼ�������֪������Խ��Խ���ã�+3�۵����������ΪClO2-��
B��A+C������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl- �� ��Ӧ��=��64kJ/mol+2��0kJ/mol��-3��60kJ/mol=-116kJ/mol�����Ը��Ȼ�ѧ��Ӧ����ʽΪ3ClO-��aq��=ClO3-��aq��+2Cl-��aq����H=-116kJ/mol��
���Դ��ǣ�ClO2-��3ClO-��aq��=2Cl-��aq��+ClO3-��aq����H=-116kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������仯�����������ͬ���ǣ� ��
A.����ȼ��
B.̼��Ƹ��·ֽ�
C.пƬ��ϡ���ᷴӦ
D.������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��еĽ����ͷǽ����ķֽ��߸������ҵ�( )
A. ���²���B. �뵼�����
C. ��ũҩԭ��D. �ƴ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2��g��+F2��g��=2HF��g����H=��270kJ/mol������˵����ȷ���ǣ� ��
A.����ͬ�����£�1mol H2��1mol F2�������ܺʹ���2mol HF���������
B.1mol H2��1mol F2��Ӧ����2molҺ̬HF�ų�������С��270kJ
C.�÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
D.�÷�Ӧ���̵������仯������ͼ����ʾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���������ͼ����һ��ת����ϵ��ѡ���ǣ� ��
X | Y | Z | |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu��OH��2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |

A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���ۺ����ð����ܶ�棬��ͼ�ǴӺ�ˮ��ͨ��һϵ�й���������ȡ��Ʒ������ͼ��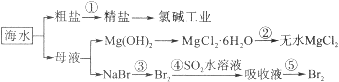
��ˮ����Ҫ����Na+��K+��Mg2+��Ca2+��Cl-��Br-��SO42-��HCO3-�����ӡ�
��֪��MgCl2��6H2O��������Mg(OH)Cl��HCl����ȡ��ش��������⣺
��1����ˮpHԼΪ8��ԭ����Ҫ����Ȼ��ˮ�����������е���
��2����ȥ������Һ�е����ʣ�Mg2+��SO42-��Ca2+��������ҩƷ��˳�����Ϊ��
��NaOH��Һ ��BaCl2��Һ �۹��˺������ ��Na2CO3��Һ
��3�����̢�����MgCl2��6H2O�Ƶ���ˮMgCl2 �� Ӧ��β�����
��4���������Ƕ��������ȼҵ�еĵ�ⱥ��ʳ��ˮ��һ����ת��Ϊ�Ĺ��̡�����ʯī���������������������ڵ��Ȼ�þ��������Ӧ�Ļ�ѧ����ʽΪ�����ʱ����������ˮ���ڻ���ɲ�Ʒþ�����ģ�д���йط�Ӧ�Ļ�ѧ����ʽ��
��5���ӵڢ۲����ڢܲ���Ŀ���������á���������������Ũ��ˮ�д���Br2 �� ����SO2���ա���Ҫ��Ӧ�Ļ�ѧ����ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е�ع���ʱ��O2�������ŵ���ǣ� ��
|
|
|
|
A��п�̵�� | B������ȼ�ϵ�� | C��Ǧ���� | D�����ӵ�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��α��Ƽ�(D)���¿�̩�˵ijɷ�֮һ���ܹ������ðʱ�����ı�����������ʹ������֢״������һ�ֺϳ�·�����£�
�ش��������⣺
��1��α��Ƽ�(D)�ķ���ʽΪ��B�к��еĹ���������д���ƣ���
��2��д�� B��C��Ӧ�Ļ�ѧ����ʽ����C��D�ķ�Ӧ����Ϊ��
��3��B����ȥ����������ںϳɸ߷��ӻ�����E����д�� E�Ľṹ��ʽ����
��4����������Ҫ���A��ͬ���칹�����֣�
���ܷ���������Ӧ
�ڱ����ϵ�һ�ȴ��������ֽṹ���к˴Ź�������Ϊ4��壬�ҷ����֮��Ϊ6:2:1:1��Ϊ��д�ṹ��ʽ����
��5����֪�� ![]() �� ���������ϳ�·�ߣ����һ���ɱ�������Ϊ��ʼԭ���Ʊ�
�� ���������ϳ�·�ߣ����һ���ɱ�������Ϊ��ʼԭ���Ʊ� 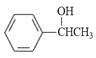 �ĺϳ�·�ߣ���
�ĺϳ�·�ߣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ӻ��������������ȷ���� ( )
A. ���ӻ������ж��������Ӽ�
B. ���ӻ������е�������ֻ���ǽ�������
C. ���ӻ�������ܺ��й��۽�
D. ����ˮ���Ե���Ļ����ﲻһ�������ӻ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com