
【题目】下列关于离子化合物的叙述不正确的是 ( )
A. 离子化合物中都含有离子键
B. 离子化合物中的阳离子只能是金属离子
C. 离子化合物可能含有共价健
D. 溶于水可以导电的化合物不一定是离子化合物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图一所示。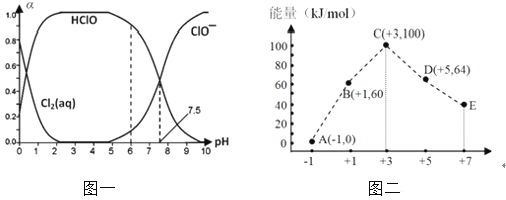
(1)已知HClO的杀菌能力比ClO-强,由图一分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是。氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为。
(2)ClO2是一种易爆炸的强氧化性气体,是一种良好的新型消毒剂。工业上可用Cl2氧化NaClO2溶液制取ClO2 , 该反应的化学方程式为。最近,科学家又研究出了在酸性溶液中用草酸钠(Na2C2O4)还原氯酸钠制取ClO2的方法,该反应的离子反应方程式为。此法的优点是。工业上还可用电解法制备ClO2 , 在80℃时电解氯化钠溶液得到NaClO3 , 然后与盐酸反应得到ClO2。电解过程中NaClO3在极(填“阴”或“阳”)生成,生成ClO3–的电极反应式为。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1、2、3、4)的能量大小与合价的关系如图二所示。从能量角度看,C、D、E中最不稳定的离子是(填离子符号)。B → A + D反应的热化学方程式为(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列各组物质(其中酸是过量的)同时加入水中,最后能得到无色透明的溶液的是
A. FeCl3、KOH、H2SO4 B. Ba(OH)2、H2SO4、HCl
C. CuSO4、NaOH、HNO3 D. Na2CO3、Ca(OH)2、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯的结构和性质,下列说法正确的是( )
A.![]() 与
与 ![]() 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列
是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列
B.苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中生成物的总能量大于反应物的总能量的是( )
A.H﹣Cl→H+Cl
B.H+H→H﹣H
C.Zn+H2SO4=ZnSO4+H2↑
D.HCl+NaOH=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内物质为少量杂质)的方法中,正确的是
A. 乙烷(乙烯):光照条件下通入Cl2,气液分离
B. 乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液
C. CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶
D. 乙醇(乙酸):加足量浓硫酸,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题.
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1 
若温度升高,则反应的平衡常数K将(填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02molL﹣1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= .
(3)已知:反应1:2SO2(g)+O2(g)2SO3(g)△H1;
反应2:2NO(g)+O2(g)2NO2(g)△H2;若△H1<△H2<0,则反应3:SO2(g)+NO2(g)SO3(g)+NO(g)属于(填“放热”或“吸热”)反应.
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(如图2).电解时阳极的电极反应式为 .
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡.两次平衡时NO2的转化率α1α2(填“>”、“<”、“=”);请在如图3画出正反应速率v正在10至30min间随时间变化的曲线图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂,这种有机物不可能发生的反应是( )
A.加聚反应B.取代反应C.水解反应D.氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com