
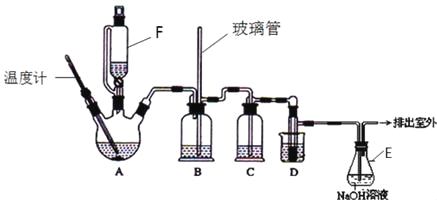
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
【答案】(1) CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
(2) b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3) C
(4)吸收挥发出来的溴,防止污染环境
(5) 蒸馏
(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞;
【解析】试题分析:(1) 乙醇发生消去反应生成乙烯和水,方程式为:CH3CH2OH![]() CH2=CH2↑+H2O,D中乙烯和溴发生加成反应生成1,2-二溴乙烷,方程式为:CH2=CH2+Br2→CH2BrCH2Br;(2)若装置中出现堵塞,则b中水面会下降,玻璃管中的水柱会上升,甚至溢出;(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫 ,二氧化碳、二氧化硫能和氢氧化钠溶液反应,所以在装置C中应加入氢氧化钠溶液,吸收反应中可能生成的酸性气体,所以选C;(4)氢氧化钠能和溴反应生成溴化钠和次溴酸钠和水,所以用氢氧化钠可以吸收挥发出来的溴,防止污染环境。(5)1,2-二溴乙烷沸点132℃,乙醚34.6℃,1,2-二溴乙烷与乙醚的沸点相差较大,两者均为有机物,互溶,用蒸馏的方法将它们分离;(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞。
CH2=CH2↑+H2O,D中乙烯和溴发生加成反应生成1,2-二溴乙烷,方程式为:CH2=CH2+Br2→CH2BrCH2Br;(2)若装置中出现堵塞,则b中水面会下降,玻璃管中的水柱会上升,甚至溢出;(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫 ,二氧化碳、二氧化硫能和氢氧化钠溶液反应,所以在装置C中应加入氢氧化钠溶液,吸收反应中可能生成的酸性气体,所以选C;(4)氢氧化钠能和溴反应生成溴化钠和次溴酸钠和水,所以用氢氧化钠可以吸收挥发出来的溴,防止污染环境。(5)1,2-二溴乙烷沸点132℃,乙醚34.6℃,1,2-二溴乙烷与乙醚的沸点相差较大,两者均为有机物,互溶,用蒸馏的方法将它们分离;(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A.两者都为s-s σ 键
B.两者都为p-p σ 键
C.前者为p-p σ 键,后者为s-p σ 键
D.前者为s-s σ 键,后者为s-p σ 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.由2H和18O所组成的水11g,其中所含的中子数为5NA
D.1L0.1mol·L-1Na2CO3溶液中含有的阴离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、N、C![]() 、N、OH-、S
、N、OH-、S![]() ,将这4种溶液分别标记为A、B、C、D并进行如下实验:①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
,将这4种溶液分别标记为A、B、C、D并进行如下实验:①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)A的化学式是 ,判断理由是 。
(2)写出其他几种物质的化学式:B 、C 、D 。
(3)写出实验③中气体被B吸收的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
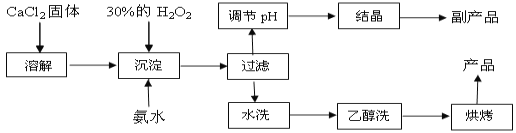
(1)“溶解”过程需要的玻璃仪器有 ;“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 ;为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;该制法的副产品为 (填化学式);若称取11.1g无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“偏高”、“偏低”、“无影响”、“不能确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是 ( )
A. 碱性:KOH> Mg(OH)2>NaOH
B. 酸性:H3PO4>H2SO4>HClO4
C. 原子半径:K>Na>Mg
D. 氢化物稳定性:NH3>H2O>HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
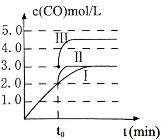
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
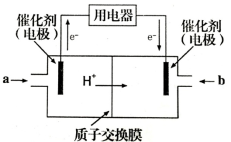
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com