
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
【答案】1.344低温时,KClO3溶解度小,从溶液中结晶析出1.8×10-6n(AgNO3)=0.2000 mol·-1 ×0.021L=0.0042 mol n(KCl)总=n(AgNO3)=0.0042 mol n(KClO4)+ n(KCl)=0.0042 mol n(KClO4) ×138.5 g·mol-1+ n(KCl) ×74.5 g·mol-1=0.56890g n(KClO4)=0.0040 mol m(KClO4)=0.004 mol×138.5 g·mol-1=0.554g 0.554g÷0.56890g×100%=97.38%。
【解析】
(1)电解时,产生质量为2.13gNaClO3,物质的量=![]() =0.02mol
=0.02mol
NaCl+3H2O=NaClO3 + 3H2↑
1 3
0.02mol 0.06mol
同时得到H2的物质的量为0.06mol,体积=0.06mol×22.4L/mol=1.344L,故答案为:1.344;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出,故答案为:低温时,KClO3溶解度小,从溶液中结晶析出;
(3)①若c(CrO42-)=1.1×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.1×10-12,c(Ag+)=10-4mol/L,Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6 mool/L,故答案为:1.8×10-6;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/LAgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL,n(AgNO3)=0.2000molL-1×0.021L=0.0042mol,n(KCl)总=n(AgNO3)=0.0042mol,n(KClO4)+n(KCl)=0.0042mol,n(KClO4)×138.5gmol-1+n(KCl)×74.5gmol-1=0.56890g,n(KClO4)=0.0040mol,m(KClO4)=0.004mol×138.5gmol-1=0.554g,250ml溶液中m(KClO4)=5.54g,KClO4样品的纯度=![]() ×100%=97.38%,故答案为:97.38%。
×100%=97.38%,故答案为:97.38%。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】如图1是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

(1)甲中负极的电极反应式为____________。
(2)乙中B极为_____(填“阴极”或“阳极”),该电极上析出的气体在标准状况下的体积为____。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则图中③线表示的是_________________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要___________ mL 2. 0 mol/L NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol/(L·s),则6 s末NO的浓度为
A. 1.2 mol/L B. 大于1.2 mol/L C. 小于1.2 mol/L D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4 和 Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为
A.0.15mol/L B.0.45mol/L C.0.6mol/L D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,則通入的气体可能是
A. CO2 B. NH3 C. NO2 D. Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是
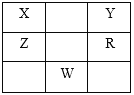
A. 原子半径大小关系为: R> Y > X
B. X有多种同素异形体,而Y不存在同素异形体
C. 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性
D. ZY2晶体熔化、液态RY3气化均需克服分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com