
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | N、P、F原子半径依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
分析 A、同周期元素的原子,从左到右,最外层电子数依次增多;
B、元素最高正价=最外层电子数;
C、电子层数越多,半径越大;电子层数相同时,核电荷数越多,半径越小;
D、同一主族元素,从上到下,金属性依次增强.
解答 解:A、Li、Be、B原子最外层电子数依次为1、2、3,逐渐增多,故A正确;
B、P、S、Cl元素最高正价依次为+5、+6、+7,逐渐升高,故B正确;
C、电子层数越多,半径越大;电子层数相同时,核电荷数越多,半径越小,N、P、F中P的核外有3个电子层,而N和F的核外均有2个电子层,但由于N的核电荷数小,故半径大,即半径P>N>F,故C错误;
D、Na、K、Rb是同主族元素,从上到下的金属性依次增强,故D正确;
故选C.
点评 本题考查学生元素周期律的应用知识,可以根据所学知识来回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用惰性电极电解饱和NaCl溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 等体积等物质的量浓度的Ca(HCO3)2与NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L 氢气含有氢分子个数为NA | |
| B. | 标准状况下,11.2 L 水含有水分子个数为0.5NA | |
| C. | 1L 0.3mol•L-1Na2SO4 溶液中,含有Na+和SO42- 总数为0.6NA | |
| D. | 18g水含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A. | M是芳香族化合物,它的分子式为C9H5O4Cl | |
| B. | 1mol M最多能与含2 mol Br2的溴水发生反应 | |
| C. | 1mol M分别与足量的NaOH溶液、Na2CO3溶液反应,消耗两种物质的物质的量分别为4mol、2mol | |
| D. | 在一定条件下能发生取代、加成、水解、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
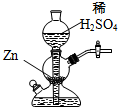
| A. | 将稀硫酸改为浓硫酸 | B. | 向稀硫酸中加入少量CuSO4固体 | ||
| C. | 向稀硫酸中加入AgNO3溶液 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率不相同 | |
| B. | 容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 | |
| C. | 容器I中反应的平衡常数小于Ⅲ中 | |
| D. | 容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍还多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com