
【题目】如表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。
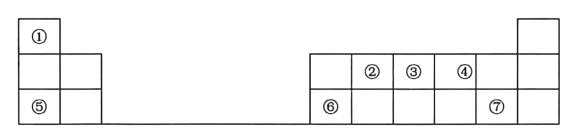
请按要求回答下列问题:
(1)元素②的元素名称是____。
(2)元素⑤处于周期表中第____周期第___族。
(3)①⑦七种元素中原子半径最大的是___(填元素符号)。②③④三种元素的最简单氢化物中最稳定的是____(填化学式)。
(4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该白色物质发生分解的化学方程式______。
(5)元素⑥的最高价氧化物对应的水化物是一种____性氢氧化物,该物质与元素⑦的最高价氧化物对应水化物反应的离子方程式为_____。
【答案】碳 三 IA Na H2O ![]() 两
两 ![]()
【解析】
根据元素周期表推断各种元素种类;根据元素周期律分析各元素的性质和结构;
根据元素在周期表中的位置分析可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Cl,
(1)元素②的元素是碳元素;
(2)元素⑤是Na元素,处于周期表中第三周期第IA族;
(3)同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则①⑦七种元素中原子半径最大的是第三周期最左边的Na;同周期元素从左到右,非金属性逐渐增强,②③④三种元素的非金属性,O>N>C,非金属性越强,气态氢化物就越稳定,则其最简单氢化物中最稳定的是H2O;
(4)元素③是N和元素⑦是Cl,它们的氢化物分别为NH3和HCl,它们反应生成的是NH4Cl,NH4Cl受热分解生成HCl和NH3,方程式为:NH4Cl![]() NH3↑+HCl↑;
NH3↑+HCl↑;
(5)元素⑥是Al,它的最高价氧化物对应的水化物是Al(OH)3,是一种两性氢氧化物,元素⑦是Cl,它的最高价氧化物的水化物为HClO4,Al(OH)3和HClO4反应生成Al(ClO4)3和水,离子方程式为Al(OH)3 + 3H+ = Al3+ + 3H2O;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)
FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)![]() H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系式_____,据此关系式及上表数据,也能推断出反应③是____(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中CO的浓度
(4)图甲、图乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲t2时刻改变的条件是___。②图乙t2时刻改变的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
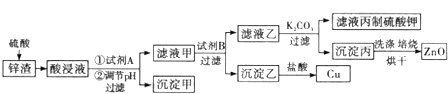
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质。常温下,E是一种无色无味的液体,它们之间有如下反应关系。
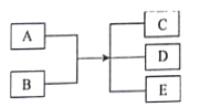
(1)若A是一种具有磁性的黑色金属氧化物,B是一种常见的非氧化性酸,A和B反应的离子方程式为__;若在生成物C中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式__。A与CO高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式__。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性![]() 溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。

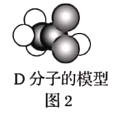
请回答下列问题:
(1)A的结构简式为_____,E中的官能团名称为______。
(2)由B生成C的反应类型是_____,由B生成E的反应类型是___。
(3)A反应生成B的化学方程式为____。
(4)B在一定条件下可以生成某种高分子化合物,该高分子化合物的链节是_____。
(5)C物质存在一种同分异构体,该同分异构体属于有毒的一类致癌物,其别名为恶烷,曾被广泛的用于洗涤,制药,印染等行业,试推测其结构简式_____。
(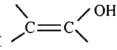 结构不稳定)
结构不稳定)
(6)C在![]() 条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
(7)在实验室中取![]() 和
和![]() 在浓硫酸催化条件下得到
在浓硫酸催化条件下得到![]() ,试计算该反应产物的产率是______。(保留三位有效数字)
,试计算该反应产物的产率是______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
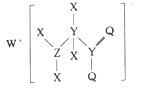
A.WX的水溶液呈中性
B.元素非金属性的顺序为Y>Z>Q
C.Z的最高价氧化物对应的水化物是一元强酸
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com