
化学与生活、生产和环境等社会实际密切相关。下列说法正确的是
A.处理废水时加入明矾作为消毒剂可以除去水中的杂质
B.利用铜、锶、钡等金属化合物的焰色反应制造节日烟花
C.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
D.PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
在蒸发皿中加热蒸干下列物质的溶液,再灼烧(溶液低于400℃)可以得到原溶质固体的是
A.AlCl3 B.NaHCO3 C.MgSO4 D.KMnO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:实验题
(16分)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取20 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取4 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________,检验是否存在该杂质的方法是____________________________。该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:_____________________________。
Ⅱ.测定产率
将所得产品配成500ml溶液,取该溶液20ml,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O62-+2I-
(5)滴定至终点时,溶液颜色的变化:____________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,则该实验的产率为_____。(保留三位有效数据)

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<sp(AgI) |
B | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>HCO3— |
C | 向蓝色石蕊试纸上滴加新制氯水 | 试纸边缘呈红色色,中间为白色 | 氯水既有酸性又有还原性 |
D | 淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴 | 无银镜出现 | 淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(15分)MMA既是一种高分子化合物(有机玻璃)的单体,又是制取甲基丙烯酸丙酯等的重要原料。现有三条制备高分子(MMA)的途径,其流程下如:

(1)工业上将A和甲醇及过量硫酸一起,一步反应生成MMA,该反应的化学方程式为 。
(2)反应②是在500℃并有催化剂存在的条件下发生的,则其反应类型为: 。
(3)某物质既能发生银镜反应,又能发生水解反应,其分子中还有手性碳原子,并与 互为同分异构体,则其物质结构简式为: 。
互为同分异构体,则其物质结构简式为: 。
(4)物质D的核磁共振氢谱有两个峰,它与CO、CH3OH以物质的量之比1︰1︰1反应恰好生成MMA, 则D的结构简式为 ,该方法的优点是 。
(5)MMA和1丙醇反应制取甲基丙烯酸丙酯的化学方程式为: 。
(6)根据题中流程里提供的新信息,写出由(CH3)2C=CH2制备化合物

的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1 mol·L-1FeCl3溶液, Fe3+的水解程度增大、溶液的pH减小
D.向0.1 mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:填空题
(15分)针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
①能否各取少许固体用舌头品尝?____________。
②用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有_________性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下
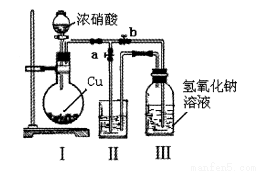
已知:2NO2+2NaOH=NaNO2+NaNO3+H2 O
①写出装置I中发生反应的化学方程式____________________________。
②水_____________(选填“能"或“不能”)作为装置II中的试剂,理由是_____________。
③装置III中反应完全后,接下来的操作是____________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_____(选填“增多”、“减少"或“不变”),原因可能是____________________________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从1000g刚煮熟的肉和1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗16.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2 O)
①滴定终点的判断依据为________________________________________________。
②隔夜熟肉中NaNO2的含量是____________mg/kg。
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com