
下列各图所示装置的气密性检查中,肯定漏气的是:

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛应用。
(1)将0.0lmol下列物质①Na2O2 ②Na2O ③Na2CO3 ④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时其负极的电极反应式是__ __;
(3)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。请写出其反应的化学方程式__ __;
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是 ;
(5)钠一钾合金可在核反应堆中用作热交换液。5.05g钠一钾合金溶于200mL水生成0.075mol氢气。则该溶液中氢氧根离子的物质的量浓度是 ;(忽略溶液体积变化)。计算并确定该钠一钾合金的化学式为 (列出计算过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
化学与生活、生产和环境等社会实际密切相关。下列说法正确的是
A.处理废水时加入明矾作为消毒剂可以除去水中的杂质
B.利用铜、锶、钡等金属化合物的焰色反应制造节日烟花
C.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
D.PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列关于各实验装置与对应现象或结论的叙述均正确的是

A.图1装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.图2装置:可用于吸收NH3或HCl气体,并防止倒吸
C.图3装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3
D.图4装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:实验题
(15分)实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示(加热及夹持装置省略):
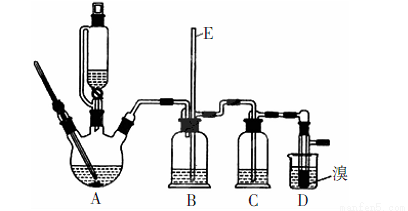
制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:

回答下列问题:
(1)装置A、D中发生主要反应的化学方程式为: ; 。
(2)装置B中长玻璃管E的作用: 。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入____,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.酸性KMnO4溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是: ;但又不能过度:冷却(如用冰水),其原因是: ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
[化学——选修3物质结构与性质](15分)
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:
2Al(OH)3 + 12HF+ 3A = 2Na3AlF6 + 3CO2↑+ 9H2O
(1)熔融晶体A时需要破坏的作用力是 ,冰晶石中的配位体是 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为 ,该分子的空间构型为 。
(3)反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小 ,写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种) 、 。
(4)某种A1-Fe合金的晶胞如图所示,该合金的化学式为 。

若晶胞的边长为a nm,则合金的密度为 g cm-3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
某澄清透明溶液中只可能含有①Al3+,②Mg2+,③Fe3+,④Fe2+,⑤H+,⑥CO32-, ⑦NO3- 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是

A.②⑤⑥⑦ B.②③⑤⑦
C.①②③⑥⑦ D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
【化学——选修3物质结构与性质】(15分)已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型
有____ (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是
A.滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+ >I2 > SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com