
����Ŀ��NO��CO�ڽ�����(Rh)�Ĵ��·�����Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)����H���÷�Ӧ���̾�������������
��Ӧ��NO(g)��CO(g)��Rh(s)=RhN(s)��CO2(g) ����H1����33.44 kJ��mol��1��
��Ӧ��RhN(s)��NO(g)=Rh(s)��N2O����H2����319.35 kJ��mol��1��
��ͼ��ʾΪ�÷�Ӧ������(a)���д���(b)ʱ��Ӧ���̵������仯�Ա�ͼ��

�����й��ж���ȷ����(����)
A.��H����285.91 kJ��mol��1
B.E1Ϊ��Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)�Ļ��
C.E2Ϊʹ�ô����͵Ļ��
D.ʹ�ú��ʵĴ����ɽ��ͷ�Ӧ�Ļ�ܣ���߷�Ӧ����
���𰸡�D
��������
A����Ӧ��NO(g)��CO(g)��Rh(s)=RhN(s)��CO2(g) ����H1����33.44 kJ��mol��1����Ӧ��RhN(s)��NO(g)=Rh(s)��N2O����H2����319.35 kJ��mol��1�����ݸ�˹���ɣ�����ӦI+��Ӧ��ã�2NO(g)��CO(g)=N2O(g)��CO2(g) ��H��(��33.44 kJ��mol��1)+(��319.35 kJ��mol��1)=��352.79 kJ��mol��1����A����
B������ͼ��E1Ϊ��Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)�д���������ʱ�Ļ�ܵIJ��B����
C������ͼ��E2Ϊ�÷�Ӧ�ķ�Ӧ�ȣ���C����
D��ʹ�ú��ʵĴ����ɽ��ͷ�Ӧ�Ļ�ܣ��������Ӱٷ�������߷�Ӧ���ʣ���D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������������Ӧʵ��������� (����)
A.��������þ����Һ�еμ��Ȼ����Һ�������ܽ⣺![]()
B.���ˮ�еμӱ����Ȼ�����Һ�õ����ɫҺ�壺![]()
C.��������ʹ���Ը��������Һ��ɫ��![]()
D.��ͭ���缫���NaCl��Һ: 2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������������ͷ�չ������Ҫ���壬1909�������ʵ�������״����õ�����������Ӧ�ϳɰ���ʵ�����˹��̵���
��1����ӦN2(g)+3H2(g)![]() 2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ_____��
2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ_____��
��2�������������ݷ�������ҵ��ѡ�õ�����������Ӧ�̵�����û��ѡ�õ�����������Ӧ�̵���ԭ����______��
��� | ��ѧ��Ӧ | K(298K)����ֵ |
�� | N2(g)+O2(g) | 5��10-31 |
�� | N2(g)+3H2(g) | 4.1��106 |
��3�����ڷ�ӦN2(g)+3H2(g)![]() 2NH3(g)����һ�������°���ƽ�⺬�����±���
2NH3(g)����һ�������°���ƽ�⺬�����±���
�¶�/�� | ѹǿ/MPa | ����ƽ�⺬�� |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
�ٸ÷�ӦΪ______��������������������������Ӧ��
�ڹ���ѡ�õ�������550�桢10MPa������200�桢10MPa�����ܵ�ԭ����______��
��4��һ���¶��£����ݻ��㶨���ܱ������г���1mol������3mol������һ��ʱ���ﻯѧƽ��״̬�������������������䣬������ƽ����ϵ���ٳ���1mol������3mol������������ƽ��ת����______���������������С����������������
��5�����ܹ����ĺϳɰ�������Ϊ��20���Ϳ�ѧ��������Ի͵ijɾ���֮һ�����Դ��ں��ܸߡ����ʵ͵����⡣��ˣ���ѧ���ڳ���̽����Ѱ��ϳɰ�����·������ͼΪ��ⷨ�ϳɰ���ԭ��ʾ��ͼ�������ĵ缫��ӦʽΪ______��
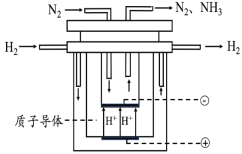
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ�ͼ��������ȷ���ǣ� ��



A.�ױ�ʾ![]() ��
��![]() ������Ӧ�����е������仯����
������Ӧ�����е������仯����![]() ��ȼ����Ϊ
��ȼ����Ϊ![]()
B.�ұ�ʾA��B�����ʵ��ܽ�����¶ȱ仯�������![]() ʱA��B�ı�����Һ�ֱ�������
ʱA��B�ı�����Һ�ֱ�������![]() ʱ�����ʵ���������
ʱ�����ʵ���������![]()
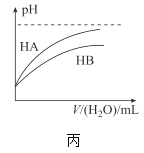
C.����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬŨ�ȵ�NaA��Һ��pHС��ͬŨ��NaB��Һ��pH
D.����ʾ![]() ��Һ�ζ�
��Һ�ζ�![]() ������Һ�õ��ĵζ�����
������Һ�õ��ĵζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A. ͼI��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B. ͼ���ʾ�����£�0.1000mol��L-1 NaOH��Һ�ζ�20.00mL 0.1000mol��L-1 CH3COOH��Һ���õ��ĵζ�����
C. ͼ���ʾһ�������ı������ˮϡ�����У���Һ�ĵ��������仯���ߣ�ͼ��a��b��c�������ĵ���̶ȣ�a��b��c
D. ͼ����ʾ��Ӧ4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ��H ��0���������������������¸ı���ʼ��CO�����ʵ���,ƽ��ʱN2����������仯�������ͼ��֪NO2��ת����b>a>c
N2(g)+4CO2(g) ��H ��0���������������������¸ı���ʼ��CO�����ʵ���,ƽ��ʱN2����������仯�������ͼ��֪NO2��ת����b>a>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ϊ��ѹ��������Ϊ������������ͬ�����³�������ʵ�����![]() ���壬����ʼʱ�����ͬ��������Ӧ��
���壬����ʼʱ�����ͬ��������Ӧ��![]() .һ��ʱ�����̴ﵽƽ��״̬����˵������ȷ����( )
.һ��ʱ�����̴ﵽƽ��״̬����˵������ȷ����( )
�� ��
��
A.ƽ��ʱ![]() �����������<��
�����������<��
B.�ﵽƽ������ʱ�䣬���������
C.�÷�Ӧ��ƽ�ⳣ������ʽ![]() )
)
D.���������������ѹǿ���ֲ��䣬��˵����Ӧ�Ѵﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A.�ڸɱ������У�ÿһ��������̼������Χ��12��������̼���ӽ�������
B.���ʯ��״�ṹ�У��ɹ��ۼ����ɵ�̼ԭ�ӻ��У���С�Ļ�����4��̼ԭ��
C.�۵��ɸߵ��͵�˳���ǣ����ʯ��̼���裾�����
D.��12g���ʯ�����У������ۼ�Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A��g��+B��g��![]() 3C��g��+4D��g����Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
3C��g��+4D��g����Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
A.v��A��=0.5mol/(L��min)B.v��D��=1mol/(L��min)
C.v��C��=0.8mol/(L��min)D.v��B��=0.3mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z�����ڱ��е�λ����ͼ��ʾ��������˵����ȷ����

A. Zһ���ǻ��õĽ���
B. Y������������ˮ������һ��ǿ��
C. Z������������ˮ������ǿ��
D. 1 molY���ʸ�����ˮ��Ӧʱ����1 mol���ӷ���ת��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com