
【题目】在容积为1L的密闭容器中,加入1.0mol A和2.2mol B进行如下反应:A(g)+2B(g)C(g)+D(g),在800℃时,D的物质的量n(D)和时间t的关系如图. 
(1)800℃时,0~5min内,以B表示的平均反应速率为 .
(2)利用图中数据计算在800℃时的平衡常数的数值为 .
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为反应(填“吸热”或“放热”).
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06molL﹣1 , c(B)=0.50molL﹣1 , c(C)=0.20molL﹣1 , c(D)=0.018molL﹣1 , 则此时该反应(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
【答案】
(1)0.24mol/(L.min)
(2)0.9
(3)吸热
(4)向正方向进行
【解析】解:(1)0~5min内,v(D)= ![]() =
= ![]() mol/(L.min)=0.12mol/(L.min),v(B)=2v(D)=2×0.12mol/(L.min)=0.24mol/(L.min), 所以答案是:0.24mol/(L.min);(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
mol/(L.min)=0.12mol/(L.min),v(B)=2v(D)=2×0.12mol/(L.min)=0.24mol/(L.min), 所以答案是:0.24mol/(L.min);(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
该反应中A(g)+2B(g)C(g)+D(g),
开始(mol/L)1.0 2.2 0 0
反应(mol/L)0.6 1.2 0.6 0.6
平衡(mol/L)0.4 1.0 0.6 0.6
化学平衡常数K= ![]() =
= ![]() =0.9,
=0.9,
所以答案是:0.9;(3)若700℃,反应达平衡时,A的浓度为0.55mol/L>0.4mol/L,说明降低温度平衡逆向移动,则正反应是吸热反应,所以答案是:吸热;(4)浓度商= ![]() =0.24<0.9,浓度商小于平衡常数,平衡向正方向进行,
=0.24<0.9,浓度商小于平衡常数,平衡向正方向进行,
所以答案是:向正方向进行.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. HNO3摩尔质量是63g
B. 硫酸(H2SO4)和(H3PO4)磷酸的摩尔质量相等
C. 摩尔质量就等于物质的相对分子质量或相对原子质量
D. 摩尔质量是物质相对分子质量或相对原子质量的6.02×1023倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别( ) 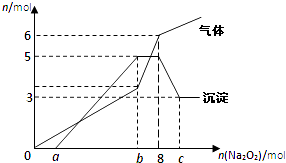
A.2 mol、3 mol、6 mol
B.3 mol、2 mol、6mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 . 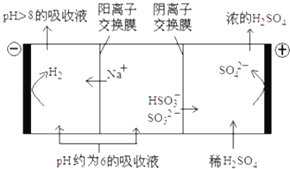
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
(2)吸收液吸收SO2的过程中,pH随n(SO32﹣),n(HSO3﹣)变化关系如下表:
n(SO32﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
PH | 8.2 | 7.2 | 6.2 |
1表判断NaHSO3溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na﹣)=2c(SO ![]() )+c(HSO
)+c(HSO ![]() )
)
b.c(Na﹣)>c(HSO ![]() )>c(SO
)>c(SO ![]() )>c(H﹣)=c(OH﹣)
)>c(H﹣)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO ![]() )+c(HSO
)+c(HSO ![]() )+c(OH﹣)
)+c(OH﹣)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3﹣在阳极放电的电极反应式是 .
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液只含有Na+、Ba2+、Al3+、Fe3+、Br-、SO42-、CO32-中两种或多种离子,取少量逐滴滴入NaOH溶液至过量,先出现白色沉淀后消失的现象;另取少量往其中滴加氯水,溶液为橙黄色;则原溶液一定不存在__________(填离子符号)。写出原溶液加入过量的NaOH溶液反应的离子方程式_______________。
(2)KClO3和浓盐酸在一定温度下的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。浓盐酸在反应中表现出来的性质是__________(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性。
反应中,若氧化产物比还原产物多0.1mol,则电子转移的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
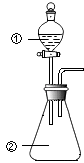
【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( ) 
A.装置Ⅰ:观察Fe(OH)2的生成
B.装置Ⅱ:除去Cl2中的HCl
C.装置Ⅲ:除去CCl4中的Br2
D.装置Ⅳ:加热分解NaHCO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.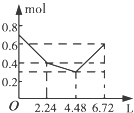
B.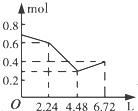
C.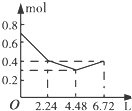
D.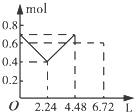
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com