
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。如图是合成具有特殊功能高分子材料W( )的流程:
)的流程:

已知:
I. ![]() R-CH2OH
R-CH2OH
II. ![]() =R2-OH
=R2-OH![]() ,R、R2、R3代表烃基
,R、R2、R3代表烃基
(1)①的反应类型是___________。
(2)②是取代反应,其化学方程式是____________________。
(3)D的核磁共振氢谱中有两组峰且面积之比是1∶3,不存在顺反异构。D的结构简式是_______。
(4)⑤的化学方程式是_________________。
(5)F的官能团名称____________________;G的结构简式是____________________。
(6)⑥的化学方程式是_________________________。
(7)符合下列条件的E的同分异构体有__________种(考虑立体异构)。
①能发生水解且能发生银镜反应 ②能与Br2的CCl4溶液发生加成反应
其中核磁共振氢谱有三个峰的结构简式是__________________。
(8)工业上也可用 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,![]() 不易发生取代反应)
不易发生取代反应)
![]() _______________。
_______________。
【答案】加成反应 BrCH2CH2Br+2NaCN→NCCH2CH2CN+2NaBr (CH3)2C=CH2 CH2=C(CH3)COOH+CH3OH![]() CH2=C(CH3)COOCH3+H2O 碳碳双键、酯基
CH2=C(CH3)COOCH3+H2O 碳碳双键、酯基 
 4 HCOO C(CH3)=CH2 HOCH2CHBrCH3
4 HCOO C(CH3)=CH2 HOCH2CHBrCH3![]() HOCH2CH(CN)CH3
HOCH2CH(CN)CH3![]() HOCH2CH(CH3)COOH
HOCH2CH(CH3)COOH![]() CH2=C(CH3)COOH
CH2=C(CH3)COOH
【解析】
乙烯与溴发生加成反应生成A,A为BrCH2CH2Br,结合B的分子式可知B为NC-CH2CH2-CN,B中-CN转化为-COOH得到丁二酸。丁二酸发生分子内脱水形成酸酐。
I与R′NH2得到W( ),结合W的结构可知I为
),结合W的结构可知I为 ,结合信息II,逆推可知H为
,结合信息II,逆推可知H为 。D的分子式为C4H8,核磁共振氢谱中有两组峰且面积之比是1∶3,不存在顺反异构,则D为(CH3)2C=CH2,D氧化生成E,E与甲醇发生酯化反应生成F,结合H的结构,可知E为CH2=C(CH3)COOH,F为CH2=C(CH3)COOCH3,F发生加聚反应生成的G为
。D的分子式为C4H8,核磁共振氢谱中有两组峰且面积之比是1∶3,不存在顺反异构,则D为(CH3)2C=CH2,D氧化生成E,E与甲醇发生酯化反应生成F,结合H的结构,可知E为CH2=C(CH3)COOH,F为CH2=C(CH3)COOCH3,F发生加聚反应生成的G为 ,G发生信息I中的反应得到H。据此分析解答。
,G发生信息I中的反应得到H。据此分析解答。
(1)根据上述分析,反应①是乙烯与溴发生加成反应,故答案为:加成反应;
(2)反应②是取代反应,其化学方程式是:BrCH2CH2Br+2NaCN→NCCH2CH2CN+2NaBr,故答案为:BrCH2CH2Br+2NaCN→NCCH2CH2CN+2NaBr;
(3) 根据上述分析,D的结构简式为(CH3)2C=CH2,故答案为:(CH3)2C=CH2;
(4)反应⑤的化学方程式为CH2=C(CH3)COOH+CH3OH![]() CH2=C(CH3)COOCH3+H2O,故答案为:CH2=C(CH3)COOH+CH3OH
CH2=C(CH3)COOCH3+H2O,故答案为:CH2=C(CH3)COOH+CH3OH![]() CH2=C(CH3)COOCH3+H2O;
CH2=C(CH3)COOCH3+H2O;
(5) F为CH2=C(CH3)COOCH3,含有的官能团有碳碳双键和酯基;G的结构简式是 ,故答案为:碳碳双键、酯基;
,故答案为:碳碳双键、酯基; ;
;
(6)反应⑥的化学方程式为 ,故答案为:
,故答案为: ;
;
(7)E为CH2=C(CH3)COOH,①能发生水解且能发生银镜反应,说明属于甲酸酯类;②能与Br2的CCl4溶液发生加成反应,说明含有碳碳双键,符合条件的E的同分异构体有:HCOO CH=CHCH3(顺反2种)、HCOO CH2 CH=CH2、HCOO C(CH3)=CH2,共4种,其中核磁共振氢谱有三个峰的结构简式为HCOO C(CH3)=CH2,故答案为:4;HCOO C(CH3)=CH2;
(8)HOCH2CHBrCH3和NaCN发生取代反应生成HOCH2CH(CN)CH3,HOCH2CH(CN)CH3酸化得到HOCH2CH(CH3)COOH,HOCH2CH(CH3)COOH发生消去反应生成CH2=C(CH3)COOH,其合成路线为HOCH2CHBrCH3![]() HOCH2CH(CN)CH3
HOCH2CH(CN)CH3![]() HOCH2CH(CH3)COOH
HOCH2CH(CH3)COOH![]() CH2=C(CH3)COOH,故答案为:HOCH2CHBrCH3
CH2=C(CH3)COOH,故答案为:HOCH2CHBrCH3![]() HOCH2CH(CN)CH3
HOCH2CH(CN)CH3![]() HOCH2CH(CH3)COOH
HOCH2CH(CH3)COOH![]() CH2=C(CH3)COOH。
CH2=C(CH3)COOH。


科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下图所示仪器装罝设计一个电解饱和食盐水,并测定电解产生氢气的 体积和检验氯气氧化性的实验装置。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母);a接 , 接 ,b接 , 接 。______________
(2)证明有Cl2生成的实验现象是____________。
(3)实验时,装置中的铁电极接电源的____________极,石墨电极的反应式为____________。
(4)装置E读取气体体积时,应进行的实验操作是____________,若实验结束后装置E的读数(已折算成标准状况)为5.60mL,电解后溶液的体积恰好为50.0mL,则溶液中OH-的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A的结构简式为________________,丙烯酸中官能团的名称为__________________________________________
(2)写出下列反应的反应类型①___________________,②________________________
(3)下列说法正确的是(________)
A.硝基苯中混有浓HNO3和H2SO4,将其倒入到NaOH溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加NaOH溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物C与丙烯酸属于同系物
(4)写出下列反应方程式:
③B→CH3CHO_________________________________________
④丙烯酸 + B→丙烯酸乙酯_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:

(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_______作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的____________(填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为__________mL。
(4)滴定。当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=__________g/100mL
(2)在本实验滴定过程中,下列操作会使结果偏大的是 _________
a.碱式滴定管在滴定时未用标准氢氧化钠溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点KW间的关系是__________________.
(2)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=2a,Va<Vb, 则a的取值范围为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
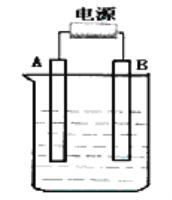
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com