
【题目】某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流计A指针偏转。下列有关描述正确的是
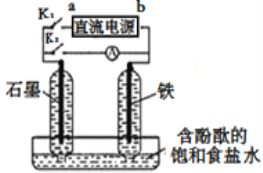
A.断开K2,闭合K1时,总反应的离子方程式为:2Cl-+2H+ ![]() H2↑+Cl2↑
H2↑+Cl2↑
B.断开K2,闭合K1时,a是电源的正极,铁电极发生氧化反应
C.断开K1,闭合K2时,石墨电极附近溶液变红,铁电极上的电极反应为:Cl2+2e—=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
【答案】D
【解析】
A. 断开K2,闭合K1时,是电解池装置,电解饱和食盐水的总反应的离子方程式为2H2O+2Cl-![]() Cl2↑+H2↑+2OH-,故A错误;
Cl2↑+H2↑+2OH-,故A错误;
B. 断开K2,闭合K1时,是电解池装置,两极均有气泡产生,说明两极产生的气体分别是氢气和氯气,因此活泼金属铁不能做阳极,应该是做阴极,则a是电源的正极,铁电极为负极,发生还原反应,故B错误;
C. 断开K1,闭合K2时,发现电流计A指针偏转,证明是原电池反应,形成氢氯燃料电池,断开K2,闭合K1时,铁电极上产生了氢气,石墨电极上产生了氯气,因此铁做负极发生氧化反应,氢气失电子生成氢离子的反应,故C错误;
D. 断开K1,闭合K2时,发现电流计A指针偏转,证明是原电池反应,形成氢氯燃料电池,断开K2,闭合K1时,铁电极上产生了氢气,石墨电极上产生了氯气,因此石墨电极作正极,故D正确;
故选D。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( )
C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( )
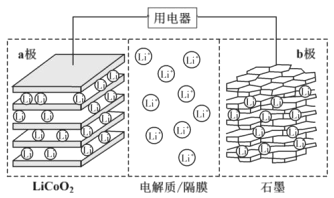
A.放电时,Li+由b极向a极迁移
B.放电时,若转移0.02mol电子,石墨电极将减重0.14g
C.充电时,a极接外电源的正极
D.该废旧电池进行“充电处理”有利于锂在LiCoO2极回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
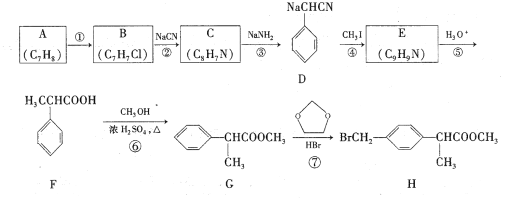
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是

A.1 mol N2(g)和NA个 O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳链增长的反应是有机合成一个重要方法,其中一个重要的反应如图:

(1)有机物A的含氧官能团名称是__;有机物B的分子式是__;
(2)按要求写出有机物A的所有同分异构体:有苯环,和A有相同的官能团__;
(3)有机物C和乙醇反应的化学方程式为(不要求写反应条件)__;
(4)有机物B其中一种制备方法如图:
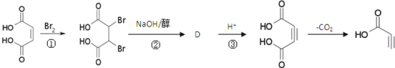
①反应①的反应类型是__;
②写出反应②的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有溶质NaCl和![]() ,物质的量之比为3:1。用石墨作电极电解该溶液,根据电极产物的不同,可明显分为三个阶段,下列叙述不正确的是( )
,物质的量之比为3:1。用石墨作电极电解该溶液,根据电极产物的不同,可明显分为三个阶段,下列叙述不正确的是( )
A.阴极只析出H2B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水D.溶液pH不断增大,最后为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S),还含有FeO、CaO、SiO2等。以辉铜矿石为原料制备CuCl2·2H2O的工艺流程如图所示:
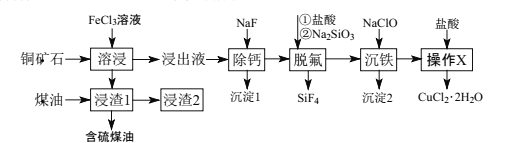
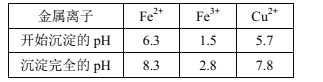
已知:Ⅰ.金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
Ⅱ.NaCl易溶于水,不溶于酒精,随温度变化溶解度变化不明显;CuCl2·H2O易溶于水,酒精,浓氨水,随温度升高溶解度变化明显增大。
Ⅲ.Ksp(CaF2)=4.0×10-11
(1)为了提高“溶浸”效率,可采取的措施是___。写出“溶浸”过程中Cu2S溶解时离子方程式:___。
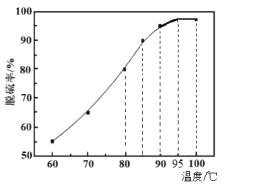
(2)“脱硫”时,随着温度的升高,脱硫率呈上升趋势(如图),原因是___。
(3)写出“脱氟”时HF发生反应的化学方程式:___。
(4)“沉铁”过程中,加入NaClO的两个作用是___。
(5)“操作X”的具体操作是___。
(6)经过“操作X”后,母液经过一系列操作可得到另外一种物质,要得到这种纯净物,最好选用下列试剂洗涤___。
A.浓盐酸 B.水 C.酒精 D.浓氨水
(7)向“浸出液”中加入NaF除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+
B.1mol·L-1CH3COOH与1mol·L-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
C.常温常压下,3.6gH2O中含有电子数为2NA
D.含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com