
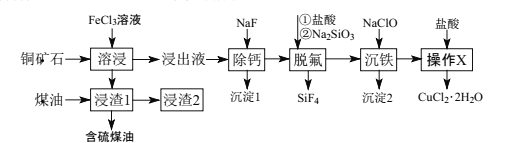
【题目】辉铜矿石主要含有硫化亚铜(Cu2S),还含有FeO、CaO、SiO2等。以辉铜矿石为原料制备CuCl2·2H2O的工艺流程如图所示:
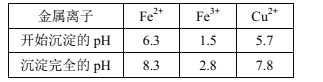
已知:Ⅰ.金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
Ⅱ.NaCl易溶于水,不溶于酒精,随温度变化溶解度变化不明显;CuCl2·H2O易溶于水,酒精,浓氨水,随温度升高溶解度变化明显增大。
Ⅲ.Ksp(CaF2)=4.0×10-11
(1)为了提高“溶浸”效率,可采取的措施是___。写出“溶浸”过程中Cu2S溶解时离子方程式:___。
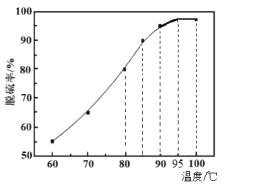
(2)“脱硫”时,随着温度的升高,脱硫率呈上升趋势(如图),原因是___。
(3)写出“脱氟”时HF发生反应的化学方程式:___。
(4)“沉铁”过程中,加入NaClO的两个作用是___。
(5)“操作X”的具体操作是___。
(6)经过“操作X”后,母液经过一系列操作可得到另外一种物质,要得到这种纯净物,最好选用下列试剂洗涤___。
A.浓盐酸 B.水 C.酒精 D.浓氨水
(7)向“浸出液”中加入NaF除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为___。
【答案】将矿石细磨(搅拌、升温或其它合理答案) Cu2S+4Fe3+=S+4Fe2++2Cu2+ 温度升高,单质硫在煤油中的溶解度增加 4HF+H2SiO3=SiF4↑+3H2O NaClO将Fe2+氧化Fe3+,消耗H+,使H+浓度减小,促使水解平衡Fe3++3H2O![]() Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀 蒸发浓缩 冷却结晶 C 99%
Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀 蒸发浓缩 冷却结晶 C 99%
【解析】
辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入煤油回收硫单质;加入NaF除去钙离子,生成CaF2沉淀,加盐酸和硅酸钠生成H2SiO3除去多余的氟离子,再用NaClO将Fe2+氧化Fe3+,消耗H+,使H+浓度减小,促使水解平衡Fe3++3H2O![]() Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;过滤后在滤液中加入盐酸调节pH,蒸发浓缩 冷却结晶,得到CuCl2·H2O。
Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;过滤后在滤液中加入盐酸调节pH,蒸发浓缩 冷却结晶,得到CuCl2·H2O。
(1)为了提高“溶浸”效率,可采取的措施是将矿石细磨(搅拌、升温或其它合理答案);“溶浸”过程中Cu2S溶解时,被Fe3+氧化,离子方程式:Cu2S+4Fe3+=S+4Fe2++2Cu2+。
故答案为:将矿石细磨(搅拌、升温或其它合理答案);Cu2S+4Fe3+=S+4Fe2++2Cu2+;
(2)“脱硫”时,随着温度的升高,脱硫率呈上升趋势,温度升高,单质硫在煤油中的溶解度增加;
故答案为:温度升高,单质硫在煤油中的溶解度增加;
(3)加盐酸和硅酸钠生成H2SiO3除去多余的氟离子,“脱氟”时HF发生反应的化学方程式:4HF+H2SiO3=SiF4↑+3H2O。
故答案为:4HF+H2SiO3=SiF4↑+3H2O;
(4)“沉铁”过程中,加入NaClO的两个作用是NaClO将Fe2+氧化Fe3+,消耗H+,使H+浓度减小,促使水解平衡Fe3++3H2O![]() Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;
Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;
故答案为:NaClO将Fe2+氧化Fe3+,消耗H+,使H+浓度减小,促使水解平衡Fe3++3H2O![]() Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;
Fe(OH)3+3H+向右移动,生成Fe(OH)3沉淀;
(5)氯化铜溶于水,则“操作X”的具体操作是蒸发浓缩 冷却结晶。
故答案为:蒸发浓缩 冷却结晶
(6)经过“操作X”后,母液经过一系列操作可得到另外一种物质,这种物质是NaCl,NaCl易溶于水,不溶于酒精,随温度变化溶解度变化不明显;CuCl2·H2O易溶于水、酒精、浓氨水,随温度升高溶解度变明显增大。所以要得到这种纯净物,最好选用洗涤剂酒精,而A.浓盐酸、B.水、D.浓氨水三个选项中提供的物质均能溶解NaCl,故答案为:C。
(7)当溶液中c(F-)=2.0×10-3mol·L-1时,Ksp(CaF2)=c(Ca2+)c2(F-)=c(Ca2+)(2.0×10-3)2= 4.0×10-11,c(Ca2+)=1.0×10-5mol·L-1,则除钙率为![]() ×100%=99%。
×100%=99%。
故答案为:99%。


科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
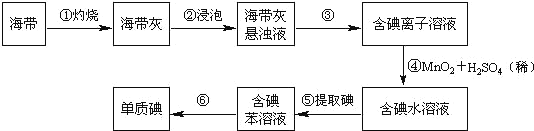
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的一些仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)步骤④反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流计A指针偏转。下列有关描述正确的是
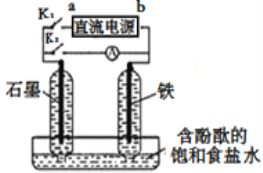
A.断开K2,闭合K1时,总反应的离子方程式为:2Cl-+2H+ ![]() H2↑+Cl2↑
H2↑+Cl2↑
B.断开K2,闭合K1时,a是电源的正极,铁电极发生氧化反应
C.断开K1,闭合K2时,石墨电极附近溶液变红,铁电极上的电极反应为:Cl2+2e—=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃条件下,向lL固定体积的密闭容器M中加入2molX和lmolY,发生如下反应:2X(g)+Y(g)![]() aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
aZ(g)+W(g) ΔH=-QkJ·mol-1(Q>0)。当反应达到平衡后,放出的热量为Q1kJ。若平衡后再升高温度,混合气体的平均相对分子质量减小。维持温度T℃不变,若起始时向容器M中加入物质的物质的量如下,则反应达到平衡后放出的热量仍为Q1kJ的是( )
A.2molX、1molY、1molAr
B.amolZ、1molW
C.1molX、0.5molY、0.5amolZ、0.5molW
D.2molX、1molY、1molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)=________。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2=2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为_____。
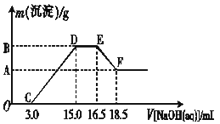
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解),纵坐标中A点的数值是________。
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为__________________。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为___g(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是( )
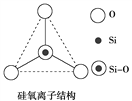
A. 键角为120° B. 化学组成为SiO![]()
C. Si原子采用sp2轨道杂化方式 D. 化学组成为SiO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
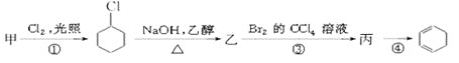
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com