
【题目】硝酸铵简称硝铵,可用作化肥,含氮量高。它在发生某些反应时既放出大量热又生成大量气体而爆炸,也可作炸药使用。
(1)硝铵受热:NH4NO3→N2O↑+2H2O,该反应中因为有____而属于氧化还原反应,其中发生还原过程元素的变化为___。
(2)硝铵受撞击:2NH4NO3→O2+2N2+4H2O,请在该反应方程式上补齐电子转移的方向和数目___。若反应中转移电子数为3.01×1024,则反应产生的气体在标准状况下的体积为____。
(3)一定温度下,硝铵分解:___NH4NO3→___HNO3+___N2↑+___H2O,配平该反应方程式,把系数填入对应的位置上。反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为___。
(4)硝铵易溶于水,溶解时溶液的温度降低。硝铵溶于水时,温度降低的原因是_____,该水溶液呈(填“酸”“碱”或“中”)____性,用离子方程式表示原因为_____。
(5)为使该水溶液在常温下的pH为7,并不引入杂质,可以_____,试证明所得的溶液中c(NH4+)=c(NO3-):_______。
【答案】电子的转移 NO3-→N2O 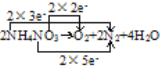 33.6 L 5 2 4 9 1000g 硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量 酸 NH4++H2O
33.6 L 5 2 4 9 1000g 硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量 酸 NH4++H2O![]() NH3H2O+H+ 加入适量氨水 溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=c(NO3-)(其他证明方法,合理即得分)
NH3H2O+H+ 加入适量氨水 溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=c(NO3-)(其他证明方法,合理即得分)
【解析】
(1)有电子转移的反应为氧化还原反应,元素化合价降低的过程为还原过程;
(2)根据化合价变化,用双线桥标出电子转移情况;根据电子转移关系计算生成气体的体积;
(3)根据得失电子守恒,配平方程式;由配平的方程式找出被氧化与被还原的原子的物质的量之差与反应物的关系,以此计算;
(4)硝酸铵溶于水吸热;硝酸铵是强酸弱碱盐,水解显酸性;
(5)由水解的离子方程式NH4++H2O![]() NH3H2O+H+,根据平衡移动来解答;根据在硝酸铵和氨水的混合溶液中存在电荷守恒关系证明。
NH3H2O+H+,根据平衡移动来解答;根据在硝酸铵和氨水的混合溶液中存在电荷守恒关系证明。
(1)在NH4NO3→N2O↑+2H2O中,NH4+中氮元素化合价从-3价升高到+1价,NO3-中氮元素化合价从+5价降低到+1价,发生电子转移,属于氧化还原反应,其中发生还原过程元素的变化为NO3-→N2O,
因此,本题正确答案是:电子的转移;NO3-→N2O;
(2)根据化合价变化,用双线桥标出电子转移为: 。由此可知,每生成2molN2转移10mol电子,则若反应中转移电子数为3.01×1024,即转移5mol电子时,则反应产生的气体为1molN2和0.5molO2,在标准状况下的体积为1.5mol×22.4L/mol=33.6L,
。由此可知,每生成2molN2转移10mol电子,则若反应中转移电子数为3.01×1024,即转移5mol电子时,则反应产生的气体为1molN2和0.5molO2,在标准状况下的体积为1.5mol×22.4L/mol=33.6L,
因此,本题正确答案是: ;33.6 L;
;33.6 L;
(3)在反应NH4NO3→HNO3+N2↑+H2O中,NH4NO3中的NH4+被氧化,NO3-部分被还原,根据得失电子守恒,配平方程式为:5NH4NO3→2HNO3+4N2↑+9H2O;
由配平方程式可知,若有5mol NH4NO3分解,被氧化与被还原的原子的物质的量之差为5mol-3mol=2mol,所以当反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为![]() ×5mol×80g/mol=1000g,
×5mol×80g/mol=1000g,
因此,本题正确答案是:5 ;2 ;4 ;9 ;1000g;
(4)硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量,使溶液的温度降低;
硝酸铵是强酸弱碱盐,水解显酸性,离子方程式为NH4++H2O![]() NH3H2O+H+,
NH3H2O+H+,
因此,本题正确答案是:酸;NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(5)由NH4++H2O![]() NH3H2O+H+可知,向硝酸铵溶液中加入适量氨水,可以使平衡逆向移动,溶液pH可以为7,且不引入杂质;
NH3H2O+H+可知,向硝酸铵溶液中加入适量氨水,可以使平衡逆向移动,溶液pH可以为7,且不引入杂质;
在硝酸铵和氨水的混合溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH
因此,本题正确答案是:加入适量氨水;溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=cc(OH-),所以c(NH4+)=c(NO3-)。


科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 正极的电极反应为:C2O42--2e-=2CO2
C. 每得到1 mol草酸铝,电路中转移3 mol电子
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入浓度均为0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:__________________
(3)乙同学设计的方案二中说明HA是弱电解质的pH的范围为__________________
(4)丙同学为了进一步证明外界条件对弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(5)若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态B核外电子占据的最高能级的电子云轮廓图形状为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型有__。
(4)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
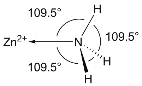
(5)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:

下列有关说法错误的是( )
A. 光照能引发酸雨的形成
B. 所涉及的变化均为氧化还原反应
C. 污染空气能加快酸雨的形成
D. 优化能源结构能有效遏制酸雨污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L的二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示![]() 。下列叙述正确的是
。下列叙述正确的是

A. Ka2(H2A)的数量级为10- 4
B. 0.1mol/L的NaHA溶液,pH=2.7
C. 向pH=0.5的溶液中逐滴加入强碱至pH=2.7的过程中,每滴一滴强碱,在X点时溶液pH变化最大
D. 0.1mol/LNa2A溶液的pH=8.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,我们不了解它们的化学式,但它们在一定条件下有下列转化关系(未配平,且四个反应均为氧化还原反应):
①G→Q+NaCl ②Q+H2O![]() X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、XB. X、Z、Q、G、Y
C. X、Z、Q、Y、GD. G、Q、Y、Z、X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com