
| 1 |
| 2 |
| 1 |
| 2 |




科目:高中化学 来源: 题型:
| A、单位时间内生成n mol O2的同时生成2n mol NO |
| B、υ (NO2)=υ (NO)的状态 |
| C、混合气体的密度不变的状态 |
| D、混合气体的平均相对分子质量不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、Cl-、AlO2- |
| B、Fe2+、Mg2+、SO42-、NO3- |
| C、Fe3+、K+、SO42-、S2- |
| D、Na+、Ca2+、OH-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯元素的相对原子质量是
| ||
B、m g该氯原子的物质的量是
| ||
| C、该氯原子的摩尔质量是17aNAg/mol | ||
| D、a g该氯原子所含质子数是17NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、荧光棒发光,凑近可燃性气体,会导致气体燃烧 |
| B、当荧光棒亮度减弱时,敲打荧光棒亮度可能增强 |
| C、荧光棒放入冷冻室亮度可能减弱甚至消失 |
| D、荧光棒发光是化学能转化为热能,热能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
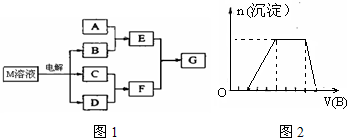
查看答案和解析>>
科目:高中化学 来源: 题型:
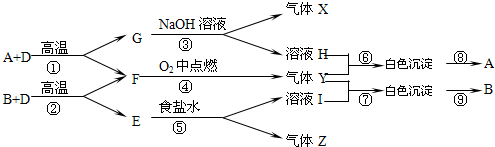
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、超临界二氧化碳与其气态或液态之间的转化是物理变化 |
| B、超临界二氧化碳的形成,引起二氧化碳化学性质的改变 |
| C、用超临界二氧化碳替代氟利昂可减轻对臭氧层的破坏 |
| D、超临界二氧化碳可用于中药、香料中有效成分的提取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com